题目内容
【题目】有一包白色固体可能由NH4Cl、Na2 SO4、Na2 CO3、Ba(OH)2、ZnCl2中的一种或几种组成,为确定其成分,进行了如下实验,请回答下列问题.
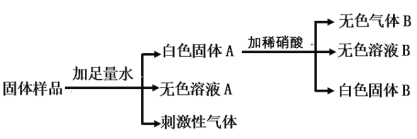
(1)刺激性气体的化学式为_____;
(2)根据流程图所示实验,能确认原白色固体中一定含有的物质是_____;
(3)取白色固体B,继续加入足量稀硝酸,若观察到仍有白色固体剩余,则产生这种剩余白色固体的反应化学方程式为_____;
(4)证明ZnCl2是否存在的实验操作为_____.
【答案】NH3 Na2 SO4、Na2 CO3、Ba(OH)2、NH4Cl Na2SO4 + Ba(OH)2==2NaOH+ BaSO4↓ 取少量的无色溶液B于试管中,滴加过量的氢氧化钠,观察现象
【解析】
向固体样品中,加入足量的水,产生白色固体、无色溶液、刺激向气体,可以判断出一定有NH4Cl,白色固体加入硝酸后有气体产生,有白色固体未溶解,可知白色固体A的成分为:BaCO3和BaSO4 故原样品中有Na2 SO4、Na2 CO3、Ba(OH)2、NH4Cl,不能确定是否有ZnCl2
(1)刺激性气体的化学是NH3,是Ba(OH)2 和NH4Cl反应的产物,故填:NH3
(2)根据流程图所示实验,分析出原白色固体中一定含有的物质是Na2 SO4、Na2 CO3、Ba(OH)2、NH4Cl,故填:Na2 SO4、Na2 CO3、Ba(OH)2、NH4Cl
(3)取白色固体B,继续加入足量稀硝酸,若观察到仍有白色固体剩余,则产生这种剩余白色固体的反应是Na2 SO4和Ba(OH)2反应生成BaSO4沉淀和Na OH,化学方程式为:
Na2 SO4 + Ba(OH)2==NaOH+ BaSO4↓,故填:Na2SO4 + Ba(OH)2==2NaOH+ BaSO4↓
(4)若含有氯化锌,则白色固体A中含有氢氧化锌固体,加入稀硝酸后生成硝酸锌,即无色溶液B中含有硝酸锌,证明ZnCl2是否存在的实验操作是:取少量的无色溶液B于试管中,滴加过量的氢氧化钠,若有白色沉淀(氢氧化锌)产生,则证明ZnCl2存在。故填:取少量的无色溶液B于试管中,滴加过量的氢氧化钠,观察现象

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案