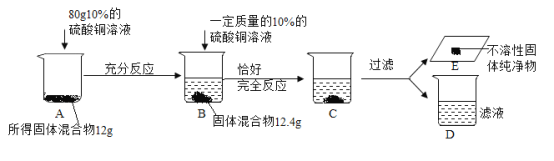
题目内容
【题目】为探究金属活动性顺序,学习小组设计并进行实验I和Ⅱ,实验结束,将两实验的废液全部倒入一洁净烧杯中,实验过程及现象如下图所示:
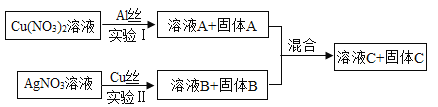
(1)实验I中反应的化学方程式为__________:
(2)实验Ⅱ中的实验现象为_________;
(3)若溶液C为蓝色,则溶液C中一定含有的溶质为__________;若溶液C为无色,则固体A的成分为__________。
【答案】2Al+3Cu(NO3)2=2Al(NO3)3+3Cu Cu表面有银白色(或黑色)物质析出,溶液由无色变为蓝色。 Cu(NO3)2 、Al(NO3)3 Al、Cu
【解析】
把硝酸铜与铝反应后的废液跟硝酸银与铜反应后的废液混合,对混合后液体进行成分分析。
(1)实验I是硝酸铜溶液与铝丝反应,反应的化学方程式为2Al+3Cu(NO3)2=2Al(NO3)3+3Cu。
(2)实验Ⅱ是硝酸银溶液与铜丝反应,生成银和硝酸铜溶液,实验现象为Cu表面有银白色物质析出,溶液由无色变为蓝色。
(3)若溶液C为蓝色,则溶液C中一定含有硝酸铜,而从实验I的可知,反应生成的硝酸铝也留在混合液C中,故C中一定含有的溶质有Cu(NO3)2 、Al(NO3)3;若溶液C为无色,则溶液C一定不含Cu(NO3)2,那么实验I的硝酸铜和实验Ⅱ硝酸银溶液与铜丝反应生成的硝酸铜已全部反应完,实验Ⅱ的硝酸铜要全部反应完,A固体就一定含有铝丝,同时A固体还一定含有实验I生成的铜。故固体A的成分Al、Cu。

 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案【题目】某班同学在学习了铁的冶炼后,欲探究炼铁高炉气体中有害气体的成分。于是他们分成甲乙两个小组,收集炼铁高炉不同时间段的气体进行探究。回答下列问题。
已知:高炉气体中一定含有二氧化碳、氮气、极少量的氧气、稀有气体等,还可能含有一氧化碳、二氧化硫等有害气体。
[提出问题]高炉气体中的有害成分是什么?
[作出猜想]猜想一:只有CO; 猜想二:只有 SO2; 猜想三:CO 和SO2都有。
甲实验小组
[查阅资料]SO2与CO2具有许多相似的化学性质:
①都能与水反应。![]() (亚硫酸);
(亚硫酸);
②SO2也能使澄清石灰水变浑浊,生成亚硫酸钙(CaSO3)白色沉淀;
③都能与氢氧化钠溶液反应,分别生成可溶性的碳酸钠、亚硫酸钠(Na2SO3)和水。
不同之处:二氧化硫能使红色品红溶液褪色,可被酸性高锰酸钾溶液吸收。
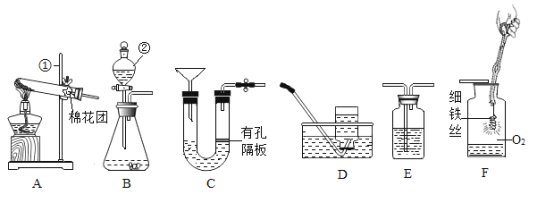
[实验探究]甲组同学设计组装如下装置进行实验。
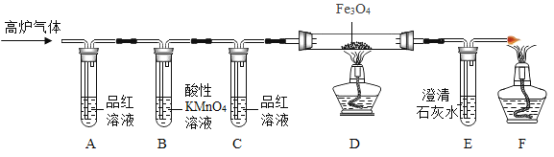
(1)A中品红溶液的作用是检验二氧化硫,B中酸性高锰酸钾溶液的作用是_____,C中品红溶液的作用是_____。
(2)观察现象发现:A中品红溶液褪色,C中品红溶液不褪色,E中澄清石灰水变浑浊。
得出结论:高炉气体中含有SO2和CO。
反思评价:部分同学认为上述结论不够准确,理由是_____。
[实验改进]同学们经过讨论后,在原有基础上改进了实验装置,如下图所示。
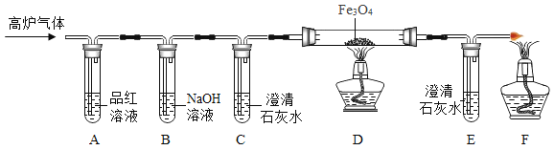
(3)用氢氧化钠溶液代替酸性高锰酸钾溶液的优点是_____,写出二氧化硫与氢氧化钠溶液反应的化学方程式_____。
乙实验小组
[查阅资料]一氧化碳能与红色氯化钯(PdCl2)溶液反应,生成黑色的金属钯(Pd)沉淀、盐酸和二氧化碳。
[实验探究]乙组同学设计如下实验装置并进行实验。
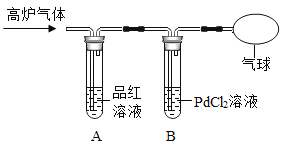
(4)B中反应的化学方程式为_____,结合已有知识和该反应可以判断:金属钯的活动性比铁_____,(填“强”或“弱”)。
[实验结论]炼铁厂排放的高炉气体中含有CO和SO2,直接排放会造成大气污染,需净化达标后才能排放。
[延伸拓展]二氧化硫排放到空气中会导致酸雨。二氧化硫与水反应生成亚硫酸,亚硫酸会被氧气进一步氧化生成硫酸。
为了研究酸雨的危害,同学们设计了如下实验探究:
②将硫燃烧的产物溶于水后,通入氧气,用所得溶液模拟硫酸型酸雨。
②模拟实验如下:
实验序号 | 所加物质 | 实验现象 |
1 | 树叶、果皮 | 树叶、果皮被腐蚀 |
2 | 细铁丝、镁条 | 产生气泡 |
3 | 石灰石、大理石碎片 | 产生气泡 |
实验结论:酸雨具有较强的危害性。
反思评价:
(5)实验室制取二氧化碳时,不能使用大理石与稀硫酸反应,但硫酸型酸雨却能腐蚀大理石雕像,其原因是_____。
(6)同学们经过讨论认为,酸雨还会加剧“温室效应”。这种说法的依据是_____。