题目内容
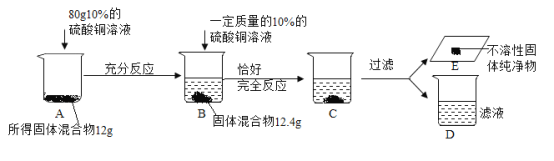
【题目】为测定经历湿法炼铜后所得固体混合物中铜元素的含量并提纯铜,进行实验如下:
(1)上述实验过程中发生反应的化学方程式为 _____;
(2)根据已知条件列出求解A烧杯中参加反应的金属质量 (X)的比例式为_____;
(3)所得固体混合物中铜、铁元素质量的最简比为_____;
(4)用16%的硫酸铜溶液配制上述实验中所用的硫酸铜溶液,需加水的体积为_____mL;
(5)将D中滤液蒸发7.2g水,最终所得不饱和溶液中溶质的质量分数为_____;
(6)冶炼60t上述所得固体混合物中的铁,需要含杂质20%的赤铁矿的质量为_____。
【答案】Fe+CuSO4=FeSO4+Cu ![]() 8:7 60 10% 428.57t
8:7 60 10% 428.57t
【解析】
(1)上述实验过程中过量的铁粉与硫酸铜溶液发生反应的化学方程式为:Fe+CuSO4=FeSO4+Cu;
(2)根据已知条件列出求解A烧杯中参加反应的金属质量 (X)的比例式为:用差量法计算,![]()
(3)解:第二次加入硫酸铜溶液恰好完全反应后,所得固体质量为12.8g,
设:混合固体中铜的质量y。
![]() y=6.4g,铁的质量为12g-6.4g-5.6g;
y=6.4g,铁的质量为12g-6.4g-5.6g;
固体混合物中铜、铁元素质量的最简比为6.4g:5.6g=8:7;
(4)用16%的硫酸铜溶液配制上述实验中所用的硫酸铜溶液,第一次加入硫酸铜溶液80g,固体质量增加0.4g,第二次加入一定量的硫酸铜溶液后,固体质量也增加0.4g,可知,第二次加入硫酸溶溶液的质量为80g,溶质质量不变,
解:设需要16%的硫酸铜溶液m。
16%m=(80g+80g)×10%;则m=100g,需要计入水的质量为160g-100g=60g;
需加水的体积为=![]() ;
;
(5)解:D中滤液中溶质为硫酸亚铁,已知铁的质量=5.6g,根据元素守恒可知硫酸亚铁的质量为![]() ;溶液质量=两次加入的硫酸铜溶液质量+被溶解铁的质量-析出铜的质量=80g+80g+5.6g-6.4g=159.2g;
;溶液质量=两次加入的硫酸铜溶液质量+被溶解铁的质量-析出铜的质量=80g+80g+5.6g-6.4g=159.2g;
将D中滤液蒸发7.2g水,最终所得不饱和溶液中溶质的质量分数为=![]()
(6)解:设需要含杂质20%的赤铁矿的质量为z。
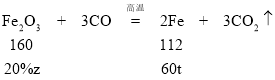
![]()
z≈428.57t
需要含杂质20%的赤铁矿的质量为428.57t。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案【题目】请从A或B中任选一个作答,若两题均作答,按A计分。

A | B |
(1)用高锰酸钾制取氧气,发生装置应选取_____(填序号),该反应的化学方程式为_____。 (2)用C装置收集氧气时,验满的操作是_____。 | (1)用过氧化氢和二氧化锰制取氧气,发生装置应选取_____(填序号),该反应的化学方程式为_____。 (2)可用E装置收集氧气的原因是_____。 |