题目内容
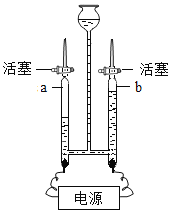
【题目】已知甲酸(HCOOH)具有挥发性,在热的浓硫酸中分解生成一氧化碳和水。用如图微型实验装置制取CO,然后用CO还原Fe3O4,并检验气体产物。(注:NaOH固体用于除去杂质,得到纯净的CO)
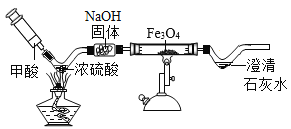
(1)写出处理尾气的一种方法_____
(2)写出B处Fe3O4发生反应的化学方程式_____
(3)C处观察到的实验现象是_____。
【答案】在装置尾部放一燃着的酒精灯或气球收集 4CO+Fe3O4 3Fe+4CO2 澄清的石灰水变浑浊
3Fe+4CO2 澄清的石灰水变浑浊
【解析】
(1)尾气中含有一氧化碳,一氧化碳有毒,排放到空气中会污染空气,一氧化碳具有可燃性,处理尾气的方法是在装置尾部放一燃着的酒精灯燃烧掉或用气球收集起来。
(2)B处发生反应的化学方程式为:4CO+Fe3O4![]() 3Fe+4CO2
3Fe+4CO2
(3)二氧化碳能使澄清石灰水变浑浊,C处观察到的实验现象是澄清石灰水变浑浊。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
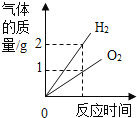
名校名卷单元同步训练测试题系列答案【题目】定性和定量是研究化学实验的两种方法,我们可以通过观察某个实验现象来定性认识,也可以通过称量化学反应前后的质量变化来定量研究。通常瓦斯气体可能含有CO、CO2、CH4等气体,某兴趣小组为确定该气体是否含有这三种气体中的一种或几种,初步设计了如下实验方案供大家讨论:
已知:CH4在加热条件下会与氧化铜反应生成铜、二氧化碳和水。
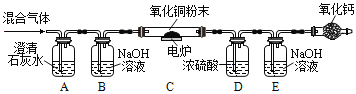
(1)实验过程若发现A处澄清石灰水变浑浊,发生的化学方程式为_____。
(2)同学甲认为,氧化钙的作用是防止空气中的_____对实验造成干扰,小组成员一致同意。
(3)同学乙认为,若装置C中CuO变红,则除了甲烷与CuO可能发生反应外,还可能发生的反应是_____;(用化学方程式表示)。
(4)装置B中装有足量NaOH溶液,其作用是: _____。
(5)同学丙认为,欲通过D装置中浓硫酸因吸收水分而增重,说明混合气体中含有CH4的思路不严密,认为需要在_____ (填序号) 间再增加一个装有_____的洗气瓶 (编号为F),才能证明含有CH4。
(6)同学丁认为该装置存在着重大安全隐患,理由是_____。综合上述讨论,兴趣小组将经过处理后的混合气体,通过改进后的装置进行了实验探究,请根据实验现象和数据填写结论:
装置 | 实验现象/数据 | 实验结论 |
A | 石灰水变浑浊 | 通过实验现象和数据,小组成员一致认为该气体样品中含有_____。 |
B | 无明显现象 | |
C | 黑色粉末变成红色 | |
D | 装置D增重1.8g | |
E | 装置E增重2.2g |
【题目】将一定量的丙烷(C3H8)和氧气置于一个密闭的容器中引燃并充分反应,测得反应前后各物质的质量如表所示,下列判断不正确的是( )
物质 | C3H8 | O2 | H2O | CO2 | X |
反应前质量/g | 4.4 | 12.8 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 7.2 | 4.4 | a |
A.表中a的值一定是5.6
B.若8.8g丙烷完全反应,则生成14.4g水
C.生成物X中一定含有氢元素
D.若4.4g丙烷与16.0g氧气充分反应,则无X生成