题目内容
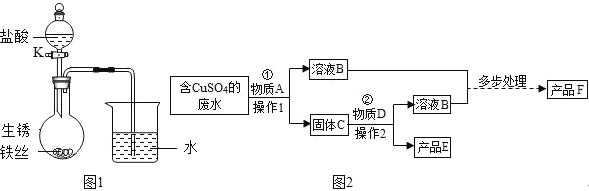
【题目】(一)某垃圾处理厂对生活垃圾进行处理与综合利用的部分流程如图:
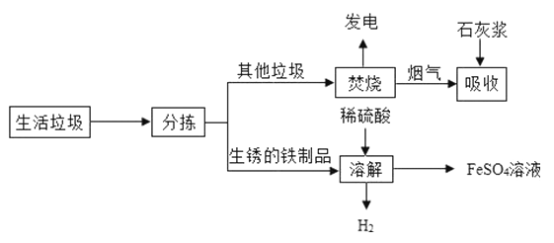
资料1:垃圾焚烧产生的烟气中含有SO2、HCl等有害气体。
资料2:+2价的铁元素容易被空气中的氧气氧化。
请回答下列问题:
(1)发电厂是利用垃圾焚烧产生的_____转变为电能。
(2)吸收步骤中,与石灰浆发生反应的2个化学方程式分别为:①_____;②_____。
(3)溶解步骤中,发生的3个化学反应方程式分别为:①_____;②_____;③_____。
(4)将所得硫酸亚铁溶液在氮气环境中加热蒸发浓缩、冷却结晶、过滤、_____(填操作名称)、干燥,得到硫酸亚铁晶体,其中氮气的作用是_____。
(5)请你对校园垃圾处理提出一条建议_____。
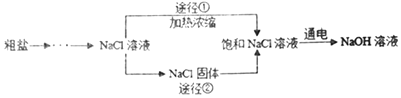
(二)已知某粗盐样品中含有Na2SO4、MgCl2、CaCl2等杂质。实验室提纯流程如下:
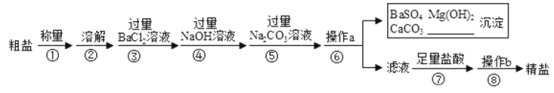
(1)用托盘天平称量粗盐时,若指针偏向右边,则表示(填下列正确选项的代码)_____。
A 右盘重,砝码轻 B 右盘轻,样品重 C 左盘重,样品轻 D 左盘轻,砝码重
(2)第③步操作发生反应的化学方程式是_____。
(3)第⑤步操作的目的是_____。
(4)第 ⑧步操作b的名称是_____,此步操作中玻璃棒的作用是_____。
(5)在第⑦步操作中,向滤液中滴加足量盐酸的目的是_____。
【答案】热能 SO2+Ca(OH)2=CaSO3↓+H2O 2HCl+Ca(OH)2=CaCl2+2H2O Fe2O3+3H2SO4=Fe2(SO4)3+3H2O Fe+H2SO4=FeSO4+H2↑ Fe2(SO4)3+Fe=3FeSO4 洗涤 作保护气,防止FeSO4被空气中的氧气氧化 分类回收利用 D Na2SO4+BaCl2=BaSO4↓+2NaCl 除尽CaCl2和BaCl2 蒸发 搅拌,使液体均匀受热,防止液滴飞溅 除尽NaOH和Na2CO3
【解析】
(一)(1)发电厂是利用垃圾焚烧产生的热能转变为电能,故填:热能。
(2)吸收步骤中,氢氧化钙能与二氧化硫反应生成亚硫酸钙和水,氢氧化钙能与盐酸反应生成氯化钙和水,故填::①SO2+Ca(OH)2=CaSO3↓+H2O;②2HCl+Ca(OH)2=CaCl2+2H2O。
(3)溶解步骤中,铁锈能与硫酸反应生成硫酸铁和水,铁能与硫酸反应生成硫酸亚铁和氢气,铁能与硫酸铁反应生成硫酸亚铁,故填:①Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;②Fe+H2SO4=FeSO4+H2↑;③Fe2(SO4)3+Fe=3FeSO4。
(4)将所得硫酸亚铁溶液在氮气环境中加热蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到硫酸亚铁晶体,其中氮气的化学性质很稳定,可以作保护气,防止FeSO4被空气中的氧气氧化。故填:洗涤;作保护气,防止FeSO4被空气中的氧气氧化;
(5)校园垃圾处理可以分类回收利用,故填:分类回收利用。
(二)(1)用托盘天平称量粗盐时,若指针偏向右边,说明左盘轻,砝码重,故填:D;
(2)第③步加入氯化钡是为了除去硫酸钠,发生反应的化学方程式是Na2SO4+BaCl2=BaSO4↓+2NaCl,故填:Na2SO4+BaCl2=BaSO4↓+2NaCl。
(3)第⑤步操作加入的碳酸钠溶液,能除尽CaCl2和BaCl2.故填:除尽CaCl2和BaCl2。
(4)第 ⑧步操作b的名称是蒸发,此步操作中玻璃棒的作用是搅拌,使液体均匀受热防止液滴飞溅。故填:蒸发;搅拌,使液体均匀受热,防止液滴飞溅。
(5)在第⑦步操作中,向滤液中滴加足量盐酸是为了除尽NaOH和Na2CO3.故填:除尽NaOH和Na2CO3。

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案【题目】某实验小组用石墨做电极进行电解水实验,为增加导电性,改用Ca(OH)2饱和溶液进行电解,实验时除两个电极均有气泡冒出外,溶液中还出现了白色浑浊,该小组对白色浑浊出现的原因进行了如下探究。
(猜想与假设)
① 溶液温度升高导致Ca(OH)2析出而出现白色浑浊。
② 水减少导致Ca(OH)2析出而出现白色浑浊。
③ 与石墨电极有关。
(查阅资料)
① Ca(OH)2的溶解度:20℃时为0.16 g,100℃时为0.07 g。
② 在加热条件下铜能与氧气反应生成黑色的氧化铜。铜与稀硫酸不反应;氧化铜能与稀硫酸反应。
(进行实验)
实验 | 实验装置 | 主要实验操作 | 实验现象 |
1 | 取20mLCa(OH)2 饱和溶液加热至沸腾 | 溶液中未出现白色浑浊 | |
2 |
| 取Ca(OH)2饱和溶液于烧杯中,加5 ml水,通电3 min | 烧杯中溶液体积几乎无明显变化,溶液中明显出现白色浑浊 |
3 | 更换石墨电极为铜电极,取Ca(OH)2 饱和溶液于烧杯中,通电3 min | 与电源正极相连的铜电极变黑,溶液中未出现白色浑浊 |
(解释与结论)
(1)实验1得出的结论是_______。
(2)实验2通电3 min后得到的溶液为_______(填“饱和”或“不饱和”)溶液。
(3)猜想与假设②不成立,依据的现象是_______。
(4)实验3中更换石墨电极为铜电极的目的是_______。
(反思与评价)
(5)为除去实验3中铜电极上的黑色物质,需要的试剂是______。
(6)通过探究过程,用石墨做电极进行实验时,Ca(OH)2溶液中出现白色浑浊的原因是_______。
【题目】某兴趣小组利用如图装置探究温度对CO还原Fe2O3的影响(固定装置略).
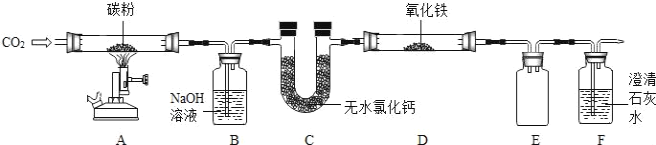
(1)F装置内溶液变浑浊的化学反应方程式为_____;A装置内发生的反应属于_____反应(选填放热或吸热).
(2)装置B的作用是_____.处理尾气的方法为_____.
(3)将该小组分为两组,各取48g氧化铁粉末按如图装置进行对比实验.甲组用酒精灯(火焰温度5000C~7000C)、乙组用酒精喷灯(火焰温度8000C~10000C)分别对装置D充分加热,红色粉末均变为黑色粉末.两组分别用固体产物进行实验,记录如下.
操作步骤 | 甲组现象 | 乙组现象 |
1.称量反应后粉末质量(g) | 44.2 | 33.6 |
2.取黑色粉末用磁铁吸引 | 部分能被磁铁吸引 | 全部能被磁铁吸引 |
3.取黑色粉末加入足量稀盐酸,震荡 | 部分溶解,无气泡 | 全部溶解,有气泡 |
为解释这个现象,小组成员查阅到下列资料:
Ⅰ.已知铁的氧化物有FeO、Fe3O4、Fe2O3,在一定条件下,均能失去或逐步失去其中的氧,最终被还原为铁.
Ⅱ.Fe3O4是一种铁氧体磁性物质,不溶于水和酸.
Ⅲ.氧化铁和一氧化碳进行热反应分析的相关数据图.
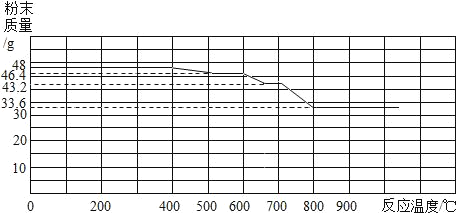
(分析与结论)
①乙组的固体产物是_____,产生气泡的化学方程式为_____.
②小军根据实验现象推测甲组的固体产物可能是_____.小华通过计算也证明了小军的观点.试通过计算说明他的推测依据._____
(反思与交流)
考虑到一氧化碳气体通入的不持续性,装置E的作用是_____.从实验安全的角度考虑,上图装置还要采取的改进措施是_____.