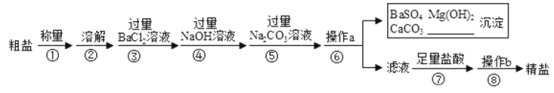
题目内容
【题目】分析与推理是化学学习常用的方法.
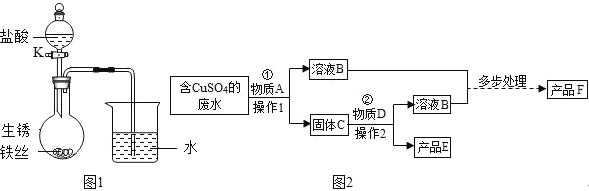
(1)已知,铁与氯化铁溶液发生如下反应:Fe+2FeCl3=3FeCl2.如图1所示,将一段生锈的铁丝放入烧瓶中,打开K向烧瓶中加入一定量的稀盐酸后,关闭K,看到烧瓶中的固体完全消失,烧杯中导管口有气泡冒出,此时烧瓶中含铁元素的物质可能的组合是_____、_____(不一定填满).
(2)从含有大量硫酸铜的工业废水中提取铜,同时获得氧化铁的工业流程如图2(废水中的其他物质不参与反应,且部分产物未标出):
①操作1、操作2均为_____.
②写出物质A、产品F的化学式:A_____;F_____.
写出反应②的化学反应方程式:_____.
(3)已知向碳酸钠溶液中逐滴加入盐酸,随盐酸量的增加先后发生如下两个反应:
①Na2CO3+HCl=NaHCO3+NaCl;②NaHCO3+HCl=NaCl+H2O+CO2↑.取10.6g Na2CO3配成溶液,向其中逐滴加入100g溶质质量分数为3.65%的稀盐酸,理论上_____(填“有”或“没有”)CO2气体产生.
【答案】FeCl2 FeCl3、FeCl2 过滤 Fe; Fe2O3 Fe+H2SO4=FeSO4+H2↑ 没有
【解析】
根据“Fe+2FeCl3=3FeCl2”,“生锈的铁丝”,考虑稀盐酸与铁反应生成氯亚铁和氢气;稀盐酸与氧化铁反应生成氯化铁和水,打开K,向烧瓶中加入一定量甲的稀溶液后,关闭K,看到烧瓶中的固体完全消失,烧杯中导管口有气泡冒出.此时烧瓶中所得溶液的溶质组成可能的几种情况是:只有FeCl2;FeCl3、FeCl2;HCl、FeCl2;HCl、FeCl3、FeCl2,所以烧瓶中含铁元素的物质可能的组合是FeCl2;FeCl3、FeCl2;故填:FeCl2;FeCl3、FeCl2;
(2)物质A是过量的铁,加入A发生 Fe+CuSO4═FeSO4+Cu.所得固体C是铁和铜的混合物,溶液B是硫酸亚铁的溶液.固体C加物质D,D是稀硫酸,和铁反应和铜不反应,所以产品E是铜.溶液B是铁和硫酸反应生成硫酸亚铁和氢气,所以溶液B是硫酸亚铁,产品F就是氧化铁,分离固体和液体的方法是过滤,所以操作1、操作2均为过滤.故答案为:①过滤;②Fe;Fe2O3;③Fe+H2SO4=FeSO4+H2↑;
(3)设碳酸钠和盐酸反应生成碳酸氢钠消耗的氯化氢的质量为x.
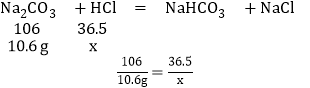
x=3.65g
100g×3.65%=3.65g,所以盐酸和碳酸钠恰好反应生成碳酸氢钠和氯化钠,所以没有气体产生.
故答案为:没有.

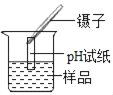
【题目】(1)如图1是实验室制取气体的一些装置,据图回答:
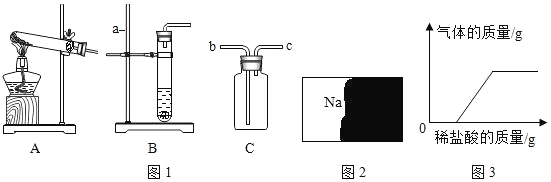
①图B中仪器a的名称是_____。
②用高锰酸钾制取氧气的发生装置是A,写出高锰酸钾制取氧气的化学方程式:_____,若用C装置收集氧气,验满时,应将带火星的木条放在_____ (填“b”或“c”)端导口,若木条复燃,说明氧气已满。
(2)实验室有一瓶溶液的标签被污损(如图2所示),兴趣小组的同学们对溶液的溶质产生了兴趣并进行了如下探究。
(提出问题)该溶液的溶质是什么?
(猜想)同学们认为可能是:氯化钠、氢氧化钠、碳酸钠、硫酸钠、硝酸钠中一种。
(查阅资料)氯化钠、硫酸钠、硝酸钠溶液呈中性。
(进行实验)
实验操作 |
|
|
实验数据或现象 | pH>7 | _____ |
实验分析与结论 | 溶质不是_____ | 溶质为碳酸钠 |
(反思评价)(1)上述实验中的错误操作可能导致的后果是_____。
(2)细心的小婧将稀盐酸逐滴加入样品中,并绘制了如图3所示的图象,得出了不同的结论,反应的化学方程式为_____ (写一个即可)。她分析后认为原溶液中的溶质是_____,图象出现这种情况的原因是_____。
(启示)从实验中可得到的启示是_____。
A 倾倒液体药品时,标签应朝向手心以免污损标签
B 药品用完后要及时盖上瓶盖,以免药品变质
C 实验后的废液不能乱倒,可能污染环境
【题目】向下表的甲物质中逐滴加入相应的乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用如图曲线表示的是( )
序号 | 甲 | 乙 |
① | HNO3和Mg(NO3)2的混合溶液 | KOH溶液 |
② | Ag﹣Zn合金 | 稀H2SO4 |
③ | 久置空气中的铝片 | 稀盐酸 |
④ | 含有Na2CO3的NaOH溶液 | 稀HNO3 |
⑤ | HCl和H2SO4的混合酸 | Ba(NO3)2溶液 |
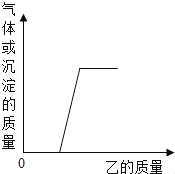
A. ②⑤ B. ①③④ C. ①②④ D. ①③⑤