题目内容
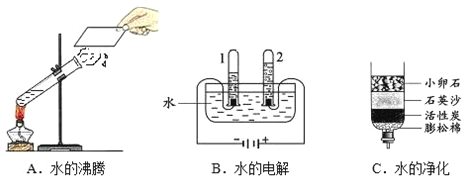
【题目】某同学设计的工业制备氢氧化钠的流程如图。

资料:2NaCl+2H2O![]() 2NaOH+H2↑+C12↑,两电极,一端得到NaOH和H2,另一端得到Cl2。
2NaOH+H2↑+C12↑,两电极,一端得到NaOH和H2,另一端得到Cl2。
(1)晾晒海水得到粗盐的原理是______。
(2)实验室蒸发用到的仪器有铁架台(带铁圈)、坩埚钳、石棉网、酒精灯、玻璃棒和______。
(3)工业生产中应选择途径______(填“①”或“②”),理由是______。
(4)Cl2可用于生产84消毒液(有效成分NaClO),反应原理为:Cl2+2NaOH=NaCl+NaClO+H2O,反应前后氯元素的化合价有______种。
【答案】蒸发结晶 蒸发皿 ① 操作简单 3
【解析】
(1)氯化钠的溶解度受温度变化影响较小,所以晾晒海水得到粗盐的原理是蒸发结晶;
(2)实验室蒸发用到的仪器还有蒸发皿;
(3)工根据流程图可以看出,途径①的步骤简单,所以工业生产中应选择途径①;
(4)反应前后氯气中氯元素为0价,反应后氯化钠中氯元素的化合价为-1价,反应后次氯酸钠中氯元素的化合价为+1,所以反应前后氯元素的化合价有3种。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】小花同学发现自己的铜制眼镜框表面出现了绿色的铜锈。为了弄清铜绿的组成和铜生锈生成铜绿的条件,小花与她们的化学实验小组进行了如下探究实验:
(一)探究铜绿的组成。
(查阅资料)“铜锈”主要成分是Cu2(OH)2CO3(俗称铜绿);铜绿受热易分解。
(实验设计)
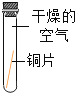
①小花同学从铜制眼镜框上取下适量的干燥铜绿,按图所示装置进行实验。在实验过程中,观察到:试管口有水珠出现,说明了铜绿中含有_________元素;澄清石灰水变浑浊,说明了铜绿中含有________元素。
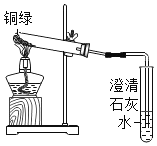
②小阳取下少量试管内反应后的剩余物,放人另一支试管中,滴入稀硫酸,充分反应后,溶液变蓝色,说明铜绿中含有___________元素。
(实验结论)③______________________________________________________________________________。
(二)探究铜生锈的条件。
(查阅资料)1铜绿受热会分解成三种氧化物。
①写出铜绿分解的化学方程式为_______________________________________________________________。
2碱石灰主要成分是氢氧化钠和氧化钙固体的混合物,实验室常用氢氧化钠溶液吸收二氧化碳气体、常用碱石灰除去二氧化碳气体和水蒸气。
(实验设计)借鉴课本“铁钉锈蚀条件的探究”实验,小平设计了“铜片锈蚀条件的探究”实验,实验如下图所示将四小块铜片分别按下图所示放置一个月,观察现象如下:
实验装置 |
|
|
|
|
实验现象 | 铜片不生锈 | 铜片不生锈 | 铜片不生锈 | 铜片生锈且水面附近锈蚀最严重的 |
(实验结论)②铜生锈是铜与氧气、___________、__________等物质共同作用的结果。
(反思应用)③写出防止铁或铜等金属制品生锈的两种不同原理的方法__________________________________________________________________________________________________。