题目内容
【题目】工业用石灰石吸收废气中的二氧化硫,并制取石膏(主要成分为硫酸钙),简易流程如图,主要的反应为:2CaCO3 + O2 + 2SO2 = 2CaSO4 + 2X。
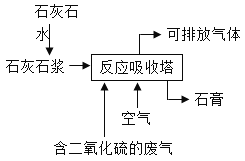
(1)主要反应中物质X的化学式为:___________。
(2)反应前后,硫元素化合价从+4→ __________。
(3)减少二氧化硫的排放,主要为了___________。(填序号)
A减少酸雨形成 B减少温室效应 C防止破坏臭氧层
(4)若处理含有3.2kg二氧化硫的废气,要将其完全吸收,至少需要碳酸钙______kg。
【答案】CO2 +6 A 5
【解析】
(1)由2CaCO3+O2+2SO2═2CaSO4+2X可知,反应前后钙原子都是2个,硫原子都是2个,反应前碳原子是2个,反应后应该是2个,包含在2X中,反应前氧原子是12个,反应后应该是12个,其中4个包含在2X中,因此主要反应中物质X的化学式为CO2.
故填:CO2.
(2)根据化合物中元素化合价代数和为零可知,二氧化硫中硫元素的化合价是+4,硫酸钙中硫元素的化合价是+6,因此反应前后,硫元素化合价从+4→+6.
故填:+6.
(3)减少二氧化硫的排放,主要为了减少酸雨形成.
故选:A.
(4)设至少需要碳酸钙质量为x,
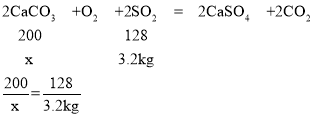
x=5kg,
答:至少需要碳酸钙质量是5kg.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目