题目内容
【题目】铁是目前世界年产量最高的金属。请回答。
(1)下图中,用铁锅炒菜是利用了金属铁的性
A.导热性 B.导电性
(2)如图所示是课堂中模拟炼铁的实验装置。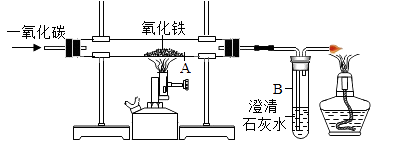
①实验过程中,先要进行的是(填“I”或“Ⅱ”)。
I.加热 Ⅱ.通一氧化碳
②加热一段时间后,A装置玻璃管内的现象是 , A装置中发生反应得化学方程式为。
③一氧化碳有毒,并会污染空气,你认为该装置是否需要添加尾气处理装置 , (填“需要”或“不需要”),井说明理由
【答案】
(1)导热
(2)Ⅱ;红棕色粉末逐渐变黑;Fe2O3+3CO ![]() 2Fe+3CO2;需要;因为未反应的CO进入B装置中,会逸散到空气中(合理即可)
2Fe+3CO2;需要;因为未反应的CO进入B装置中,会逸散到空气中(合理即可)
【解析】(1)下图中,用铁锅炒菜是利用了金属铁的导热性;(2)①先通一氧化碳,②加热一段时间后,A装置玻璃管内的现象是红棕色粉末变黑,化学方程式为3CO+ Fe2O3 ![]() 2Fe + 3CO2; ③该装置需要添加尾气处理装置,因为未反应的CO进入B装置中,会逸散到空气中。
2Fe + 3CO2; ③该装置需要添加尾气处理装置,因为未反应的CO进入B装置中,会逸散到空气中。
故答案为:导热;Ⅱ;红棕色粉末逐渐变黑;Fe2O3+3CO ![]() 2Fe+3CO2;需要;因为未反应的CO进入B装置中,会逸散到空气中(合理即可);本题主要考察金属的性质及其利用,一般金属具有特殊金属光泽,能导电导热的固体,金属的冶炼反应之前先通气体在加热,反应完过后先停止解热在停止同气体。
2Fe+3CO2;需要;因为未反应的CO进入B装置中,会逸散到空气中(合理即可);本题主要考察金属的性质及其利用,一般金属具有特殊金属光泽,能导电导热的固体,金属的冶炼反应之前先通气体在加热,反应完过后先停止解热在停止同气体。

【题目】某同学为测定实验室中某氯酸钾样品的纯度,取2.5g该样品与0.5g二氧化锰混合,加热该混合物t1时间后(杂质不参加反应),冷却,称量剩余固体质量,重复以下操作,依次称得加热t2、t3、t4时间后剩余固体的质量,记录数据如下表
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量(g) | 2.68 | 2.52 | 2.04 | 2.04 |
(1)加热至t3时间时,氯酸钾是否已经完全反应?(填“是”或“否”).
(2)完全反应后产生氧气的质量是g.
(3)计算t2时刻,样品中有多少氯酸钾发生了分解?