题目内容
 (2012?浦口区二模)在溶液中较难制得纯净的Fe(OH)2,原因是Fe(OH)2不稳定,在水中只要有一点氧气就极易反应生成红褐色沉淀Fe(OH)3.
(2012?浦口区二模)在溶液中较难制得纯净的Fe(OH)2,原因是Fe(OH)2不稳定,在水中只要有一点氧气就极易反应生成红褐色沉淀Fe(OH)3.写出其反应的化学方程式:
4Fe(OH)2+O2+2H2O═4Fe(OH)3
4Fe(OH)2+O2+2H2O═4Fe(OH)3
.用下面两种精心设计的方法可以制得白色的Fe(OH)2沉淀.
方法一:
用不含氧气的蒸馏水配置FeSO4溶液与NaOH溶液,然后反应制备.
a.除去蒸馏水中溶解的氧气,常采用
加热
加热
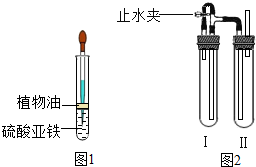
的方法.b.如图所示,用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.试管中油层的作用是
隔绝空气,避免氧气的干扰?
隔绝空气,避免氧气的干扰?
.方法二:
用如图2装置来制备.
a在装置Ι中加入Fe和稀H2SO4,写出其反应的化学方程式
Fe+H2SO4═FeSO4+H2↑
Fe+H2SO4═FeSO4+H2↑
;在装置Ⅱ中加入NaOH浓溶液.b为了制得白色Fe(OH)2沉淀,需要下列步骤,其顺序为
①③④②⑤
①③④②⑤
①气密性检查 ②气体验纯 ③加入试剂塞紧橡皮塞 ④打开止水夹 ⑤夹紧止水夹.
c.写出试管Ⅱ中发生的化学反应方程式
FeSO4+2NaOH═Fe(OH)2↓+Na2SO4
FeSO4+2NaOH═Fe(OH)2↓+Na2SO4
、H2SO4+2NaOH═Na2SO4+2H2O(或H2SO4+Fe(OH)2═FeSO4+2H2O)
H2SO4+2NaOH═Na2SO4+2H2O(或H2SO4+Fe(OH)2═FeSO4+2H2O)
.这样生成的Fe(OH)2沉淀能较长时间保持白色.分析:根据反应物、生成物及方程式的书写方法写方程式;
方法一:
a、根据气体溶解度与温度的关系来考虑;
b、加入植物油防止空气中氧气进入,避免干扰;
方法二:
a、铁与稀硫酸反应生成硫酸亚铁和氢气;
b、分析装置特点,明确实验目的,确定实验步骤;
c、由于铁与硫酸反应生成了硫酸亚铁,可能还有没反应的硫酸;然后根据物质间的化学反应书写方程式.
方法一:
a、根据气体溶解度与温度的关系来考虑;
b、加入植物油防止空气中氧气进入,避免干扰;
方法二:
a、铁与稀硫酸反应生成硫酸亚铁和氢气;
b、分析装置特点,明确实验目的,确定实验步骤;
c、由于铁与硫酸反应生成了硫酸亚铁,可能还有没反应的硫酸;然后根据物质间的化学反应书写方程式.
解答:解:根据Fe(OH)2不稳定,在水中,只要有一点氧气就极易发生反应生成Fe(OH)3,可推出反应物为Fe(OH)2、水、氧气生成物为Fe(OH)3利用奇偶法配平,方程式是
4Fe(OH)2+2H2O+O2═4Fe(OH)3;
方法一:
a、由于气体的溶解度与温度成反比,所以煮沸即可将水中的氧气除去;
b、注入植物油防止空气中氧气进入;
(3)用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下也是为了防止空气中氧气进入;
方法二:a、Fe和稀H2SO4反应生成硫酸亚铁和氢气,已经平了,注意上升符号的标法;
b、有关气体的制取,所以要检查装置的气密性,检查完毕在装置中加入试剂并塞上塞子,打开止水夹,Ⅰ中生成氢气进入装置Ⅱ,要检验装置Ⅱ中空气是否排尽,要在装置Ⅱ导管口检验气体的纯度,待气体纯净,关闭止水夹,Ⅰ中气压增大,使Ι中的药品进入Ⅱ中,与Ⅱ中的药品反应得到氢氧化亚铁;
c、由于铁与硫酸反应生成了硫酸亚铁,可能还有没反应的硫酸;氢氧化钠与硫酸亚铁反应生成氢氧化亚铁沉淀和硫酸钠,氢氧化钠与硫酸反应生成硫酸钠和水,硫酸与氢氧化亚铁反应生成硫酸亚铁和水;
故答案为:?
4Fe(OH) 2+O2+2H2O═4Fe(OH)3;?
方法一:a.加热;
b.隔绝空气,避免氧气的干扰;?
方法二:a.Fe+H2SO4═FeSO4+H2↑;
?b.①③④②⑤;?
c.FeSO4+2NaOH═Fe(OH)2↓+Na2SO4?(必写);
H2SO4+2NaOH═Na2SO4+2H2O (或H2SO4+Fe(OH)2═FeSO4+2H2O).
4Fe(OH)2+2H2O+O2═4Fe(OH)3;
方法一:
a、由于气体的溶解度与温度成反比,所以煮沸即可将水中的氧气除去;
b、注入植物油防止空气中氧气进入;
(3)用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下也是为了防止空气中氧气进入;
方法二:a、Fe和稀H2SO4反应生成硫酸亚铁和氢气,已经平了,注意上升符号的标法;
b、有关气体的制取,所以要检查装置的气密性,检查完毕在装置中加入试剂并塞上塞子,打开止水夹,Ⅰ中生成氢气进入装置Ⅱ,要检验装置Ⅱ中空气是否排尽,要在装置Ⅱ导管口检验气体的纯度,待气体纯净,关闭止水夹,Ⅰ中气压增大,使Ι中的药品进入Ⅱ中,与Ⅱ中的药品反应得到氢氧化亚铁;
c、由于铁与硫酸反应生成了硫酸亚铁,可能还有没反应的硫酸;氢氧化钠与硫酸亚铁反应生成氢氧化亚铁沉淀和硫酸钠,氢氧化钠与硫酸反应生成硫酸钠和水,硫酸与氢氧化亚铁反应生成硫酸亚铁和水;
故答案为:?
4Fe(OH) 2+O2+2H2O═4Fe(OH)3;?
方法一:a.加热;
b.隔绝空气,避免氧气的干扰;?
方法二:a.Fe+H2SO4═FeSO4+H2↑;
?b.①③④②⑤;?
c.FeSO4+2NaOH═Fe(OH)2↓+Na2SO4?(必写);
H2SO4+2NaOH═Na2SO4+2H2O (或H2SO4+Fe(OH)2═FeSO4+2H2O).
点评:本题考查了学生读取信息,并应用信息解题的能力;学会看图,能看懂题目中所给的装置图,每一部分的作用,才能明确反应怎么进行,从而正确解答.

练习册系列答案
 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目
 (2012?浦口区二模)如图为两种物质在水中的溶解度曲线.下列说法正确的是( )
(2012?浦口区二模)如图为两种物质在水中的溶解度曲线.下列说法正确的是( ) (2012?浦口区二模)某校课外活动小组的同学们利用水的电解实验探究水的组成,他们量取192.7mL水(水的密度为1.00g/cm3),并向水中加入了7.3g氢氧化钠固体,充分溶解后按图所示的装置进行实验,接通电源,当A管收集到22.3mL气体(气体密度为0.09g/L)时,停止实验.请分析回答:
(2012?浦口区二模)某校课外活动小组的同学们利用水的电解实验探究水的组成,他们量取192.7mL水(水的密度为1.00g/cm3),并向水中加入了7.3g氢氧化钠固体,充分溶解后按图所示的装置进行实验,接通电源,当A管收集到22.3mL气体(气体密度为0.09g/L)时,停止实验.请分析回答: