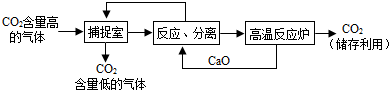
题目内容
 (2012?浦口区二模)某校课外活动小组的同学们利用水的电解实验探究水的组成,他们量取192.7mL水(水的密度为1.00g/cm3),并向水中加入了7.3g氢氧化钠固体,充分溶解后按图所示的装置进行实验,接通电源,当A管收集到22.3mL气体(气体密度为0.09g/L)时,停止实验.请分析回答:
(2012?浦口区二模)某校课外活动小组的同学们利用水的电解实验探究水的组成,他们量取192.7mL水(水的密度为1.00g/cm3),并向水中加入了7.3g氢氧化钠固体,充分溶解后按图所示的装置进行实验,接通电源,当A管收集到22.3mL气体(气体密度为0.09g/L)时,停止实验.请分析回答:(1)水通电分解的化学反应方程式为:
2H2O
2H2↑+O2↑
| ||
2H2O
2H2↑+O2↑
;
| ||
(2)实验中A管生成的气体质量是
0.002g?
0.002g?
;(3)向水中加入氢氧化钠固体的目的是
增强水的导电性
增强水的导电性
;(4)停止实验时剩余“水中”氢氧化钠的质量分数是多少?(列式计算)
| 7.3g |
| 192.7g-0.018g+7.3g |
| 7.3g |
| 192.7g-0.018g+7.3g |
分析:(1)根据电解水反应原理书写方程式;
(2)根据气体的质量=气体的密度×体积计算;
(3)水中加入氢氧化钠固体的目的是增强水的导电性;
(4)根据溶质的质量分数=
×100%求解.
(2)根据气体的质量=气体的密度×体积计算;
(3)水中加入氢氧化钠固体的目的是增强水的导电性;
(4)根据溶质的质量分数=
| 溶质的质量 |
| 溶液的质量 |
解答:解:?
(1)电解水生成氢气和氧气,方程式是2H 2O
2H2↑+O2↑;
故答案为:2H 2O
2H2↑+O2↑;?
(2)A管收集到22.3mL气体(气体密度为0.09g/L),所以得到的气体的质量是22.3mL×0.09g/L×10-3=0.002g;
故答案为:0.002g;?
(3)纯水的导电性很弱,水中可以加入稀硫酸或氢氧化钠固体增强水的导电性;
故答案为:增强水的导电性;?
(4)电解水生成的氢气和氧气的质量比是1:8,氢气的质量是0.002g,所以生成氧气的质量是0.016g;水中氢氧化钠是为了增强水的导电性,其质量不变,故停止实验时剩余“水中”氢氧化钠的质量仍然是7.3g,溶液的质量是192.7g-0.018g+7.3g,其溶质的质量分数是:
×100%=3.65%;
故答案为:
×100%=3.65%.
(1)电解水生成氢气和氧气,方程式是2H 2O
| ||
故答案为:2H 2O
| ||
(2)A管收集到22.3mL气体(气体密度为0.09g/L),所以得到的气体的质量是22.3mL×0.09g/L×10-3=0.002g;
故答案为:0.002g;?
(3)纯水的导电性很弱,水中可以加入稀硫酸或氢氧化钠固体增强水的导电性;
故答案为:增强水的导电性;?
(4)电解水生成的氢气和氧气的质量比是1:8,氢气的质量是0.002g,所以生成氧气的质量是0.016g;水中氢氧化钠是为了增强水的导电性,其质量不变,故停止实验时剩余“水中”氢氧化钠的质量仍然是7.3g,溶液的质量是192.7g-0.018g+7.3g,其溶质的质量分数是:
| 7.3g |
| 192.7g-0.018g+7.3g |
故答案为:
| 7.3g |
| 192.7g-0.018g+7.3g |
点评:本题对电解水实验的考查另辟蹊径,与溶质的质量分数很好结合,能较好考查出学生对知识的理解和掌握,解答时要根据相关知识细心分析.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
 (2012?浦口区二模)如图为两种物质在水中的溶解度曲线.下列说法正确的是( )
(2012?浦口区二模)如图为两种物质在水中的溶解度曲线.下列说法正确的是( )