题目内容
请根据下图所示的实验过程和提供的数据,解答下列问题:
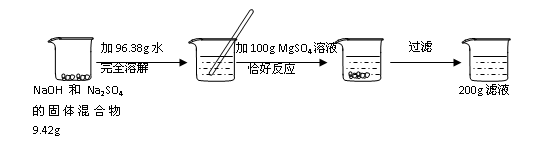
小提示:2NaOH+ MgSO4→ Na2SO4 + Mg(OH)2↓;
Na2SO4溶液不与MgSO4溶液发生反应。
(1)实验过程中,产生沉淀的质量为 g。
(2)最终所得溶液的溶质质量分数为多少?(写出计算过程)
(3)原固体混合物中钠元素的质量为 g。

小提示:2NaOH+ MgSO4→ Na2SO4 + Mg(OH)2↓;
Na2SO4溶液不与MgSO4溶液发生反应。
(1)实验过程中,产生沉淀的质量为 g。
(2)最终所得溶液的溶质质量分数为多少?(写出计算过程)
(3)原固体混合物中钠元素的质量为 g。
(1)5.8g (2)7.81% (3)5.06g
(1)产生沉淀的质量为96.38g+9.42g+100g-200g=5.8g
(2)设所得溶液中溶质硫酸钠的质量为x,原固体中氢氧化钠的质量为y
2NaOH+MgSO4=Na2SO4+Mg(OH)2↓
80 142 58
y x 5.8g
80:58=y:5.8g 解得y=8g
142:58 = x:5.8g 解得 x=14.2g
所得溶液中溶质硫酸钠的质量为9.42g-8g+14.2g=15.62g
所得溶液溶质质量分数为15.62g/200g×100%=7.81%
答:所得溶液溶质质量分数为7.81%.
(3)钠元素都转化到硫酸钠中,硫酸钠中钠元素的质量为15.62g×46/142 =5.06g
(2)设所得溶液中溶质硫酸钠的质量为x,原固体中氢氧化钠的质量为y
2NaOH+MgSO4=Na2SO4+Mg(OH)2↓
80 142 58
y x 5.8g
80:58=y:5.8g 解得y=8g
142:58 = x:5.8g 解得 x=14.2g
所得溶液中溶质硫酸钠的质量为9.42g-8g+14.2g=15.62g
所得溶液溶质质量分数为15.62g/200g×100%=7.81%
答:所得溶液溶质质量分数为7.81%.
(3)钠元素都转化到硫酸钠中,硫酸钠中钠元素的质量为15.62g×46/142 =5.06g

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2NaOH+Cl2↑+H2↑。若制得40g氢氧化钠,同时可得到氢气的质量是多少?
2NaOH+Cl2↑+H2↑。若制得40g氢氧化钠,同时可得到氢气的质量是多少? 2CaSO4 。某煤厂共加入氧化钙 560 t,则理论上可吸收二氧化硫多少吨?
2CaSO4 。某煤厂共加入氧化钙 560 t,则理论上可吸收二氧化硫多少吨?
