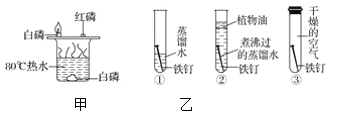
题目内容
【题目】根据实验回答下列问题:
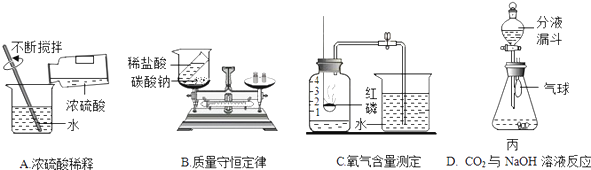
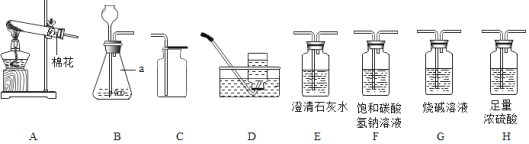
(1)A实验中的操作是:________,其中玻璃棒不断搅拌的作用是________.
(2)B实验中设计不合理的原因是________,是否符合质量守恒定律________.
(3)C实验中测得氧气含量偏大的原因可能是________(答出一点即可).
(4)D实验分液漏斗里是NaOH溶液锥形瓶中是CO2,将NaOH溶液滴入锥形瓶中,其发生反应的方程式为________,当同学发现气球涨大认为反应发生,但桐桐认为还应该补充的对比实验是________.
【答案】将浓硫酸沿着烧杯内壁缓慢的注入水中,并用玻璃棒不断的搅拌 散热 生成气体扩散到空气中会导致质量偏小 符合 燃烧匙伸入过慢或止水夹没夹紧 ![]() 用等体积的水代替氢氧化钠溶液
用等体积的水代替氢氧化钠溶液
【解析】
(1)稀释浓硫酸时,将浓硫酸沿着烧杯内壁缓慢的注入水中,并用玻璃棒不断的搅拌,其中玻璃棒不断搅拌的作用是散热;
(2)碳酸钠和盐酸反应生成的二氧化碳气体逸散到空气中,会导致质量偏小;符合质量守恒定律;
(3)如果进入集气瓶中水的体积大于五分之一,就说明燃烧匙伸入过慢或止水夹没夹紧,致使装置内的部分空气逸散出来.
(4)二氧化碳和氢氧化钠溶液反应生成了碳酸钠和水,该反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O;二氧化碳为气体,若和氢氧化钠溶液反应则会使广口瓶中气体压强减小,使气球鼓起;做对比试验,取两个同样大的矿泉水瓶充满CO2后,注入同体积的水和NaOH溶液盖上瓶盖振荡,比较两矿泉水瓶变瘪的程度.
答案:
(1)将浓硫酸沿着烧杯内壁缓慢的注入水中,并用玻璃棒不断的搅拌;散热;
(2)生成气体扩散到空气中会导致质量偏小;符合;
(3)燃烧匙伸入过慢或止水夹没夹紧
(4)2NaOH+CO2═Na2CO3+H2O;用等体积的水代替氢氧化钠溶液.