题目内容
【题目】某品牌纯碱中含有少量氯化钠。某化学探究小组为了测定该纯碱的纯度(即碳酸钠的质量分数),组内一同学设计了如下实验:
(设计实验方案)
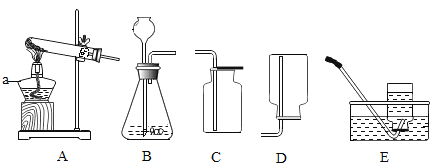
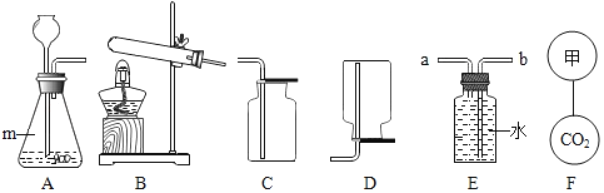
实验装置如图2所示(固定装置省略)
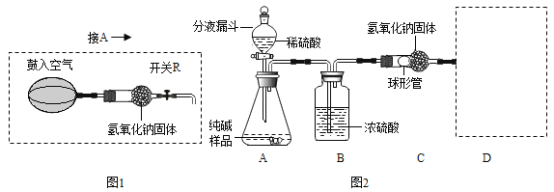
需要测定的实验数据:纯碱样品的质量;实验前、后装置(包括氢氧化钠固体)的总质量。
(1)A装置中反应的化学方程式为_________;为了保证纯碱样品中的碳酸钠完全反应,其操作是______。
(2)B装置的作用是______;C装置中反应的化学方程式为________。
(3)补充D装置_______(简要叙述或画出装置示意图)。
(交流与表达)
(4)有同学认为图2所示实验装置会导致测得纯碱的纯度偏低,为了克服图2装置的不足,有同学提出,还应增加图1装置与A装置连接(A装置中原双孔橡胶塞换成三孔橡胶塞),在反应前、后用图1装置分两次缓缓鼓入足量空气。
①反应后,用图1装置鼓入空气的作用是________。
②在A装置中的反应发生时,开关R处于________(填“打开”或“关闭”)状态。
(数据处理)
(5)称得的纯碱样品质量为10.8g,实验前、后C装置的总质量分别为75.2g和79.6g,纯碱的纯度为________%(计算结果保留到0.1%)。
(反思与评价)
(6)能否用稀盐酸代替稀硫酸?同学们经过讨论认为不能,理由是_______。
【答案】Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ 加入过量的稀硫酸 干燥二氧化碳 2NaOH+CO2= Na2CO3+ H2O 干燥装置(碱石灰或者固体氢氧化钠) 将生成的二氧化碳全部挤入C中 关闭 98.1% 盐酸具有挥发性,二氧化碳中含有氯化氢气体
【解析】
(1)A装置中碳酸钠与稀硫酸反应的化学方程式为:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;为了保证纯碱样品中的碳酸钠完全反应,其操作是 加入过量的稀硫酸;
(2)B装置中装有浓硫酸有吸水性,作用是干燥二氧化碳;C装置中氢氧化钠与二氧化碳反应的化学方程式为:2NaOH+CO2= Na2CO3+ H2O;
(3)补充D装置: 干燥装置(碱石灰或者固体氢氧化钠);
(4)①反应后,用图1装置鼓入空气的作用是将生成的二氧化碳全部挤入C中;
②在A装置中的反应发生时,开关R处于关闭状态。
(5)称得的纯碱样品质量为10.8g,实验前、后C装置的总质量分别为75.2g和79.6g,纯碱的纯度为98.1%。
解:设样品中碳酸钠的质量为x。
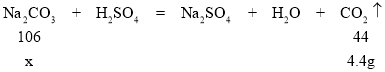
![]() x=10.6g,
x=10.6g,
则纯碱的纯度为![]() ;
;
(6)能否用稀盐酸代替稀硫酸?同学们经过讨论认为不能,理由是:盐酸具有挥发性,二氧化碳中含有氯化氢气体。