题目内容
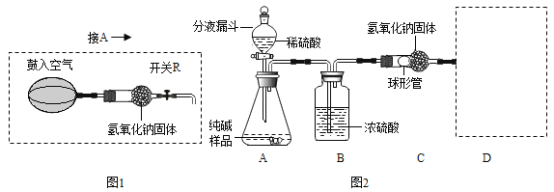
【题目】用如图装置完成以下实验:
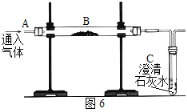
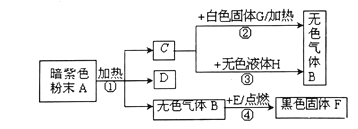
(1)探究燃烧条件:若B处盛放木炭。
Ⅰ.先在A处通入氮气一段时间后,在B处加热,B、C处没有明显变化;
Ⅱ.待B处冷却至室温,在A处通入氧气一段时间后,B、C处没有明显变化;
Ⅲ.在A处继续通入氧气,然后在B处加热,发现木炭燃烧,C处变浑浊。
Ⅰ与Ⅲ对比,说明燃烧的条件之一是____;Ⅱ与Ⅲ对比,说明燃烧的条件之一是_____。
Ⅳ.可燃冰中的主要可燃成分是甲烷。甲烷燃烧的化学方程式是___。
(2)模拟工业炼铁:若B处盛放氧化铁粉末。在A处通入一氧化碳一段时间后,B处下方用喷灯加热,B处可观察____,尾气处理的方法为______。
若工业上用100吨含氧化铁(Fe2O3)80%的赤铁矿石炼铁,理论上可以得到含铁96%的生铁__吨。
【答案】燃烧需要空气(或氧气) 温度达到可燃物的着火点 CH4+2O2![]() CO2+2H2O 红色粉末变黑 在装置最后加一个点燃的酒精灯(或气球) 58.3
CO2+2H2O 红色粉末变黑 在装置最后加一个点燃的酒精灯(或气球) 58.3
【解析】
(1)Ⅰ与Ⅲ对比,说明燃烧的条件之一是燃烧需要空气(或氧气);Ⅱ与Ⅲ对比,说明燃烧的条件之一是温度达到可燃物的着火点;
Ⅳ.可燃冰中的主要可燃成分是甲烷。甲烷在氧气中燃烧的化学方程式是:CH4+2O2![]() CO2+2H2O;
CO2+2H2O;
(2)模拟工业炼铁:若B处盛放氧化铁粉末。在A处通入一氧化碳一段时间后,B处下方用喷灯加热,一氧化碳与氧化铁反应生成铁和二氧化碳,B处可观察:红色粉末变黑,尾气处理的方法为:在装置最后加一个点燃的酒精灯(或气球) ;
解:设生成铁的质量为x。
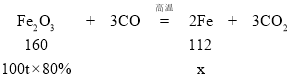
![]() x=56t
x=56t
理论上可以得到含铁96%的生铁56t÷96%≈58.3t。

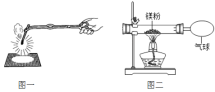
【题目】化学兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验(图一)。
(1)请写出镁条与氧气反应的化学方程式_____________。
(2)经测量发现燃烧产物的质量_______(填“大于”“小于”或“等于”)镁条的质量,分析可知出现这一结果的原因是_________。
(3)兴趣小组按图二装置改进实验后,验证了质量守恒定律,同时发现燃烧产物中有少量黄色固体。
(提出问题)黄色固体是什么呢?
(查阅资料)①氧化镁为白色固体,常温下与水不反应;②镁能与氮气反应生成黄色的氮化镁(Mg3N2)固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
(做出猜想)黄色固体为Mg3N2
(进行实验)同学们通过实验对猜想进行了验证,请你将实验记录表补充完整
实验操作 | 实验现象 | 结论 |
将镁粉燃烧的产物放在一只试管中,加入少量的蒸馏水,然后将一湿润的红色石蕊试纸放在试管口,观察现象 | _______ | 黄色固体 为氮化镁 |
(反思与交流)空气中氮气的含量远大于氧气的含量,而镁条在空气中燃烧生成的氧化镁却远多于氮化镁,是因为 ___________。镁条_________(填“能”或“不能”)代替红磷做测定空气中氧气含量的实验,因为________________。