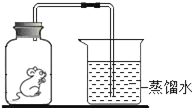
题目内容
【题目】某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。
(1)请写出镁条与氧气反应的化学方程式_____。
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵守质量守恒定律。我____(“同意”或“不同意”)小明的观点,因为___。
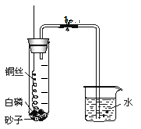
(3)小红按如图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。
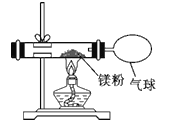
(提出问题)黄色固体是什么呢?
(查阅资料)①氧化镁为白色固体;
②镁能与氮气反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水剧烈反应产生氨气,该气体能使无色酚酞试液变色。
(做出猜想)黄色固体为Mg3N2
(实验探究)请设计实验,验证猜想
实验操作 | 实验现象 | 结论 |
(1)取样于试管中,加入少量的水 (2)将生成的气体通入到_______中 | 试管中________________ 溶液呈________色。 | 黄色固体为Mg3N2 |
(反思与交流)空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2,为什么呢?请给出合理的解释___。
【答案】2Mg + O2![]() 2MgO 不同意 因为氧气参与了反应,燃烧产物的质量等于参加反应物镁条的质量和氧气的质量总和 酚酞试液 产生大量气泡 红 O2比N2化学性质活泼
2MgO 不同意 因为氧气参与了反应,燃烧产物的质量等于参加反应物镁条的质量和氧气的质量总和 酚酞试液 产生大量气泡 红 O2比N2化学性质活泼
【解析】
(1)根据镁条在空气中燃烧的化学方程式进行分析;
(2)根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和;
(3)根据氮气的化学性质进行分析。
(1)镁与氧气在点燃的条件下反应,生成氧化镁,反应的化学方程式为:2Mg + O2![]() 2MgO;
2MgO;
(2)不同意;所有的化学反应都遵循质量守恒定律。因为氧气参与了反应,燃烧产物的质量等于参加反应物镁条的质量和氧气的质量总和;
(3)[实验探究]实验操作:(2)将生成的气体通入到酚酞试液中;实验现象:试管中产生大量气泡,溶液呈红色;
[反思与交流] O2比N2化学性质活泼。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如表所示,下列说法不正确的是( )
物质 | X | Y | Z | W |
反应前质量/g | 10 | 3 | 90 | 0 |
反应后质量/g | 3.2 | 3 | 待测 | 3.2 |
A. W可能是单质 B. Y可能是催化剂
C. 该反应是分解反应 D. 反应后Z物质的质量为![]()