题目内容
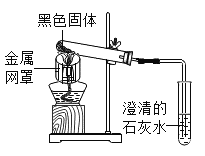
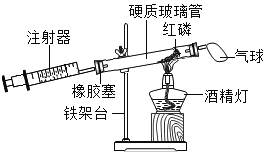
【题目】如图是某实验小组的几位同学设计的“测定空气中氧气含量”的实验装置图,请结合图示回答下列问题:
(1)根据下表提供的实验数据,完成下表:
玻璃管中空 气的体积 | 反应前注射器 中空气的体积 | 反应后注射器 中气体的体积 | 实验测得空气中 氧气的体积分数 |
25.0mL | 15.0mL | 7.0mL | ______ |
(2)玻璃管中发生反应的现象是______。
(3)装置中气球的作用是______。
(4)实际实验时测得氧气含量偏小,可能的原因有______、______(列举两条)。
(5)你认为该装置的优点有______(写一条即可)。
【答案】20% 产生大量白烟 缓冲,防止试管内气体温度升高,气压增大,冲开橡皮塞 铜粉不足 装置漏气(或装置没冷却到室温就读数等合理即可) 气密性更好,不污染环境等
【解析】
(1)实验测得空气中氧气的体积分数为:![]() ×100%=20%,故填:20%;
×100%=20%,故填:20%;
(2)磷燃烧产生五氧化二磷,玻璃管中发生反应的现象是产生大量白烟;故填:产生大量白烟;
(3)装置中气球的作用是:缓冲,防止试管内气体温度升高,气压增大,冲开橡皮塞;故填:缓冲,防止试管内气体温度升高,气压增大,冲开橡皮塞;
(4)如果铜粉不足,不能把装置中的氧气耗尽,如果装置漏气,则外面的气体会进入装置中,如果装置没冷却到室温就读数,会使装置内的气体膨胀,这些都能够导致实验测得的结果偏小。
故填:铜粉不足;装置漏气(或装置没冷却到室温就读数等合理即可);
(5)在图中,利用酒精灯加热将白磷引燃,不需要打开试管,测定结果比较准确,原因是气密性更好,且该装置不会造成环境污染等。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
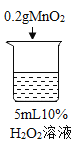
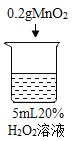
蓝天教育暑假优化学习系列答案【题目】为探究过氧化氢的分解反应,同学们进行了以下实验。
(查阅资料)过氧化氢分解放热。当氧气低于一定浓度时,可燃物无法燃烧。
(进行实验)
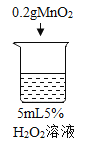
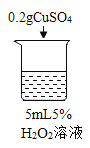
初步探究:探究影响过氧化氢分解速率的因素
序号 | 烧杯1 | 烧杯2 | 烧杯3 | 烧杯4 |
实验操作 |
|
|
|
|
实验现象 | 立即冒大量气泡,烧杯内有 少量白雾出现。 | 5分钟后,有比较大量的气泡冒出。 | 立即冒大量气泡,烧杯内有白雾。 | 立即冒大量气泡,烧杯内有大量白雾。 |
继续探究:重复烧杯1、3、4实验,并分别伸入带火星木条,如下图所示。
实验方案 | 序号 | 实验现象 |
| 烧杯1 | 木条复燃,燃烧很旺 |
烧杯3 | 木条复燃,之后火焰变微弱 | |
烧杯4 | 木条复燃,之后立即熄灭 |
span>
(结论与解释)
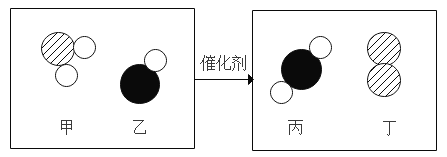
(1)写出烧杯1中反应的化学方程式_______。
(2)为证明MnO2和CuSO4能加快过氧化氢的分解速率,应增加的对比实验是_______(填具体操作)。
(3)能证明过氧化氢溶液浓度影响其分解速率的实验是_____(填烧杯的数字序号)。
(4)烧杯内出现大量白雾的原因是_______。
(反思与评价)
(5)烧杯4中木条熄灭的原因可能是_______。
(6)实验室若用双氧水制取氧气来完成木炭燃烧的实验,应选择的试剂是_______(填字母序号)。
A5%过氧化氢溶液 B10%过氧化氢溶液
C20%过氧化氢溶液 D二氧化锰
【题目】某化学小组用一定量 AgNO3 和 Zn(NO3)2 的混合溶液进行了如图所示的实验,并对溶液甲和固体乙的成分进行了分析和探究。
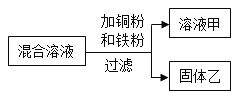
[提出问题]固体乙中的物质可能有哪些?
[做出猜想] A、只有 Ag;B、Cu、Ag; C、Fe、Cu、Ag;D、Zn、Fe、Cu、Ag
[交流讨论]不合理的猜想是________(填字母)
[实验探究]若猜想 A 成立,通过以下实验确定溶液甲中溶质的成分,请将下表填写完整。
实验步骤 | 现象 | 结论 |
取少量溶液甲,滴加_________。 | 有白色沉淀产生 | 溶液甲中的溶质是_________。 |