题目内容
【题目】活性氧化锌是重要的工业添加剂,某工厂利用工业废酸处理废弃的氧化铜锌矿(主要成分为CuO和ZnO,其余成分既不与酸反应,也不溶解于水)制取活性ZnO,进行综合利用,流程如图:
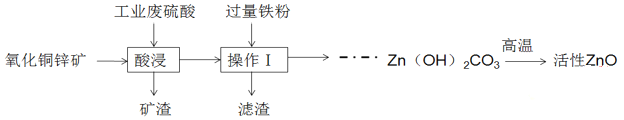
请根据流程图回答下列问题:
(1)氧化铜锌矿酸浸前要粉碎成细颗粒,其目的是_____。
(2)氧化铜锌矿中加入废硫酸后发生反应的化学方程式为_____。
(3)若在实验室进行操作Ⅰ所需的玻璃仪器有玻璃棒、烧杯和_____,滤渣的主要成分为_____(填化学式)
(4)Zn(OH)2CO3与稀盐酸反应会生成一种盐类物质,其化学式为_____.
【答案】增大反应物接触面积,使其充分反应 CuO+H2SO4=CuSO4+H2O;ZnO+H2SO4=ZnSO4+H2O 漏斗 Cu、Fe ZnCl2
【解析】
(1)反应物之间接触越充分,越有利于反应的进行,氧化铜锌矿酸浸前要粉碎成细颗粒,其目的是增大反应物接触面积,使其充分反应;
(2)氧化铜和硫酸反应生成硫酸铜和水,氧化锌和硫酸反应生成硫酸锌和水, 氧化铜锌矿中加入废硫酸后发生反应的化学方程式为CuO+H2SO4=CuSO4+H2O;ZnO+H2SO4=ZnSO4+H2O;
(3)若在实验室进行操作Ⅰ所需的玻璃仪器有玻璃棒、烧杯和漏斗,滤渣的主要成分为不与酸反应的铜和过量的铁;
(4)Zn(OH)2CO3属于碳酸盐,与稀盐酸反应会生成一种新的盐,其化学式为ZnCl2。

【题目】化学兴趣小组的同学通过查阅资料得知:过氧化氢分解除了二氧化锰作为催化剂,还可以用氧化铁、氧化铜等作为催化剂,于是他们开展了以下探究:
(探究(一))氧化铁能否做过氧化氢分解的催化剂?
项目 | 实验操作 | 实验现象 | 实验解释与结论 | |
解释 | 结论 | |||
实 验 一 | 取5mL5%的过氧化氢溶液于试管中,伸入带火星的木条 | 有气泡产生,木条不复燃 | 过氧化氢分解产生氧气,但是①_____ | 氧化铁是过氧化氢分解的催化剂 |
实 验 二 | 向盛有5mL5%过氧化氢溶液的试管中加入氧化铁,伸入带火星的木条 | ②_____ | 氧化铁能加快过氧化氢的分解 | |
(交流与反思)小岑同学认为仅由上述实验还不能得出表内的结论,他补充设计了两个方面的实验操作:第一方面的实验操作中包含了两次称量,其目的是探究反应前后氧化铁的③_____是否改变。第二方面的实验操作是利用“实验二”反应后试管内的固体剩余物继续实验,其目的是探究反应前后氧化铁的④_____是否改变。
(探究(二))为了探究不同的催化剂对过氧化氢的催化效率,兴趣小组继续设计并进行了如下实验:
实验装置 | 实验编号 | 实验药品 | 收集10mL氧气的时间(s) |
| 1 | 5mL5%的过氧化氢溶液,0.5g二氧化锰 | 30 |
2 | 5mL10%的过氧化氢溶液,0.5g氧化铁 | 60 | |
3 | 5mL10%的过氧化氢溶液,0.5g氧化铜 | 20 |
(交流与反思)
(1)探究(二)与探究(一)实验方法相同,均属于⑤
(2)写出实验1的反应的化学方程式⑥_____;
(3)如图实验装置的连接顺序依次为:a→⑦_____→⑧_____→d(填接口字母);
(4)小茜根据表中数据分析得出结论:三者中氧化铜的催化效率最高,但是小诗却认为该结论并不可靠,理由是⑨_____;同学们根据小诗的建议重新设计并进行了实验,得出了正确的结论。
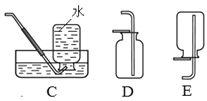
【题目】根据下列实验装置图,回答问题。
发生装置 | 收集装置 | 洗气装置 |
|
|
|
(1)写出图中仪器a的名称_____。
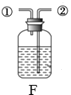
(2)写出实验室制取CO2的化学方程式_____,发生装置选择_____(填字母),如果要收集干燥的CO2,需要连接F装置,则F装置内加入的试剂是_____(选填“浓硫酸”或“氢氧化钠”),气体从_____(填①或②)端进入。
(3)实验室需少量甲烷,可用加热无水醋酸钠与碱石灰的固体混合物制得。制甲烷的发生装置应选用_____(填字母)装置,收集甲烷可选用C或E装置,由此推断甲烷具有的物理性质是_____。
(4)①实验室用锌与稀硫酸制取氢气并验证其可燃性,实验过程是:组装仪器→检查装置气密性→装入药品制备氢气→_____→点燃。
②氢气的生产方法是制约其作为清洁能源广泛使用的原因之一,科学家根据生产方法提出“绿色”氢气和“有污染”的氢气的概念,下列方法可获得“绿色”氢气的是_____。
A用矿石生产锌和硫酸,再相互反应 B利用风能、水力发电,再电解水
C利用煤燃烧发电,再电解水 D在催化剂作用下,利用太阳能光解水