题目内容
【题目】根据如图所示的实验,回答问题。
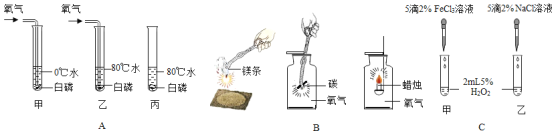
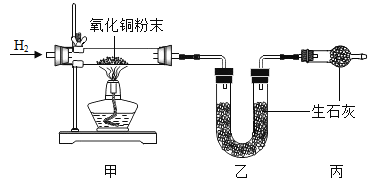
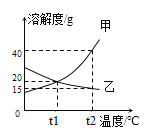
(1)A组实验中,通过对比__ 试管中的现象,可说明燃烧需要温度达到可燃物着火点。
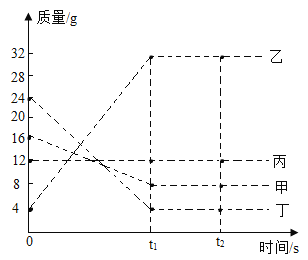
(2)B组实验中,找出三个化学变化的一个共同点___。
(3)C组实验是探究哪种离子能促进H2O2分解的实验,现象是:甲中产生大量气泡,乙中可看到有极少量气泡出现,则加快H2O2分解的离子符号____。
【答案】甲乙 反应都放热 Fe3+
【解析】
(1)说明燃烧需要温度达到可燃物着火点,应控制其它条件相同,进行分析解答。
(2)根据氧气的化学性质,进行分析解答。
(3)根据氯化铁与氯化钠的构成,进行分析解答。
(1)说明燃烧需要温度达到可燃物着火点,应控制其它条件相同,甲乙试管中除了温度不同外,其它条件相同,故通过对比甲乙试管中的现象,可说明燃烧需要温度达到可燃物着火点。
(2)三个化学变化的共同点有反应都放热、反应物中都有氧气等。
(3)甲中产生大量气泡,乙中可看到有极少量气泡出现,氯化铁与氯化钠中均含有氯离子,则加快H2O2分解的离子是铁离子,其离子符号为Fe3+。
故答案为:
(1)甲乙;
(2)反应都放热(反应物中都有氧气等合理即可);
(3)Fe3+。

 快乐5加2金卷系列答案
快乐5加2金卷系列答案【题目】复分解反应存在这样一个规律:较强酸可制取较弱酸。中和反应、盐类的水解也是复分解反应,盐类的水解反应的逆反应是中和反应。盐类的水解反应中,弱酸强碱盐中弱酸根离子对应的弱酸越弱,其盐越容易发生水解。
已知在常温下测得浓度均为0.lmol/L的下列6种溶液的pH:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 8.1 | 11.6 | 10.3 | 11.1 | 11.3 |
(1)请根据上述信息判断下列反应不能发生的是_____(填编号)。
A ![]()
B ![]()
C ![]()
D ![]()
E ![]()
F ![]()
(2)一些复分解反应的发生还遵循其他的规律、下列变化都属于复分解反应:
①将石灰乳与纯碱溶液混合可制得苛性钠溶液
②向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打固体
③蒸发KC1和NaNO3的混合溶液,首先析出NaCl晶体。
根据上述反应,总结出复分解反应发生的另一规律为_____。
(3)已知溶液的pH与氢离子浓度有直接关系。物质的量浓度均为0.05mol/L的下列五种物质的溶液中,pH由大到小的顺序是_____(填编号)。
①C6H5OH(苯酚) ②CH3COOH ③HClO4 ④HC1O ⑤H2SO4
(4)25℃时,M酸溶液的pH=a,N碱溶液的pH=b。若X为强酸,Y为强碱,且![]() ,若两者等体积混合后,溶液的pH=7.此时溶液中金属阳离子浓度大于酸根阴离子浓度,其原因可能是_____。
,若两者等体积混合后,溶液的pH=7.此时溶液中金属阳离子浓度大于酸根阴离子浓度,其原因可能是_____。