题目内容
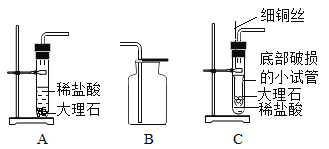
【题目】二百多年前,法国化学家拉瓦锡用定量的方法研究了空气的成分。仿照这个历史上著名实验的原理,我们可以用图1所示装置来测定空气中氧气的含量。

【提出问题】用红磷燃烧的方法为什么测出的氧气含量远低于21%?
【分析讨论】(1)实验装置漏气;(2)________________,导致装置内氧气有剩余;(3)……
【实验与交流】在老师的指导下,同学们查阅了白磷、红磷等物质燃烧需要的最低含氧量如下:
资料1:
可燃物名称 | 红磷 | 白磷 | 蜡烛 |
最低含氧量/% | 8.0 | 4.0 | 16.0 |
甲、乙、丙三个小组分别用上述过量红磷、白磷、蜡烛三种物质进行该实验,用测氧气浓度的传感器测得反应后的氧气浓度分别为8.85%、3.21%、16.7%,数据与表中的理论值基本一致。其中蜡烛燃烧后用测一氧化碳浓度传感器测算一氧化碳浓度约为2%。
资料2:蜡烛或者木炭在密闭的集气瓶中燃烧,氧气浓度会不断变小,会有一氧化碳气体生成。常温下一氧化碳难溶于水,且不与澄清石灰水反应。根据以上信息回答下列问题:
(1)白磷和红磷相比,使用白磷能使结果更准确,其原因是_______________________。
(2)请写出红磷燃烧的化学方程式______________,该反应属于___________反应(填一种基本反应类型);有同学提议选用木炭替代红磷做实验,在集气瓶底部预先放少量澄清石灰水吸收生成的二氧化碳气体,小华觉得不可行,其主要原因是________________。
(3)兴趣小组用白磷代替红磷进行实验,已知化学反应前后元素种类和质量都不发生改变,若该实验中消耗的氧气质量为0.8克,则理论上生成的五氧化二磷的质量为______。
【实验拓展】某校研究性学习小组用下图装置进行镁条在空气中燃烧的实验。燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶体积的70%。
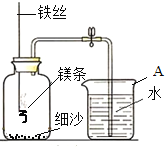
(4)实验过程中,若弹簧夹未夹紧,则进入集气瓶中的水会_______(选填“偏大”、“偏小”或“不变”)。
(5)如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的_______,现进入集气瓶中水的体积约为其容积的 70%,根据空气的组成可推出减少的气体中还一定有氮气,其理由是______________________。
【提出问题】氮气是怎样减少的呢?
【作出假设】氮气是与镁条反应而减少的。
【查阅资料】
①镁条在空气中燃烧时,不仅与空气中的氧气反应生成氧化镁,还能与氮气反应生成氮化镁(氮化镁中氮元素的化合价为-3价),请写出镁条与氮气反应的化学方程式__________;
②镁条除了能与氮气反应,还可以在二氧化碳气体中燃烧生成碳和氧化镁,请你写出该反应的化学方程式___________
【验证实验】用坩埚钳夹持镁条,点燃后迅速伸入盛有氮气的集气瓶中,镁条燃烧,发出暗红色火焰,生成淡黄色粉末,并放出大量的热。
【得出结论】镁条能在氮气中燃烧生成固体氮化镁。
【实验反思】通过以上实验探究,我们可以知道用于测定空气中氧气含量所选用的药品,应符合的条件是____________________。
【答案】 红磷的量不足 白磷消耗氧气更充分 4P+5O2![]() 2P2O5 化合 木炭在氧气浓度较低时,会生成CO气体,且CO气体难溶于水,不与澄清石灰水反应 1.42 偏大 21%或1/5 氮气约占空气组成的78%,大于49% 【答题空10】3Mg+N2
2P2O5 化合 木炭在氧气浓度较低时,会生成CO气体,且CO气体难溶于水,不与澄清石灰水反应 1.42 偏大 21%或1/5 氮气约占空气组成的78%,大于49% 【答题空10】3Mg+N2![]() Mg3N2 2Mg+CO2
Mg3N2 2Mg+CO2![]() 2MgO+C 只与空气中的氧气发生反应
2MgO+C 只与空气中的氧气发生反应
【解析】【提出问题】用红磷燃烧的方法为什么测出的氧气含量远低于21%?【分析讨论】(1)实验装置漏气;(2)红磷的量不足,导致装置内氧气有剩余;【实验与交流】资料1:资料2:(1)白磷和红磷相比,使用白磷能使结果更准确,其原因是白磷消耗氧气更充分。(2)红磷燃烧的化学方程式∶4P+5O2 ![]() 2P2O5,该反应属于化合反应,两种物质生成了一种物质;用木炭替代红磷做实验,在集气瓶底部预先放少量澄清石灰水吸收生成的二氧化碳气体,小华觉得不可行,其主要原因是木炭在氧气浓度较低时,会生成CO气体,且CO气体难溶于水,不与澄清石灰水反应。(3)用白磷代替红磷进行实验,若该实验中消耗的氧气质量为0.8克,则理论上生成的五氧化二磷的质量为∶
2P2O5,该反应属于化合反应,两种物质生成了一种物质;用木炭替代红磷做实验,在集气瓶底部预先放少量澄清石灰水吸收生成的二氧化碳气体,小华觉得不可行,其主要原因是木炭在氧气浓度较低时,会生成CO气体,且CO气体难溶于水,不与澄清石灰水反应。(3)用白磷代替红磷进行实验,若该实验中消耗的氧气质量为0.8克,则理论上生成的五氧化二磷的质量为∶
4P+5O2 ![]() 2P2O5
2P2O5
160 284
0.8g x
![]() =
=![]() ,x=1.42g.
,x=1.42g.
【实验拓展】镁条在空气中燃烧的实验。(4)实验过程中,若弹簧夹未夹紧,则进入集气瓶中的水会偏大。(5)如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的21%或1/5,现进入集气瓶中水的体积约为其容积的 70%,根据空气的组成可推出减少的气体中还一定有氮气,其理由是氮气约占空气组成的78%,大于49%。【提出问题】氮气是怎样减少的呢?【作出假设】氮气是与镁条反应而减少的。【查阅资料】
①镁条在空气中燃烧时,不仅与空气中的氧气反应生成氧化镁,还能与氮气反应生成氮化镁(氮化镁中氮元素的化合价为-3价),镁条与氮气反应的化学方程式3Mg+N2 ![]() Mg3N2 ,根据正负总价代数和为零原则,氮化镁化学式是Mg3N2;
Mg3N2 ,根据正负总价代数和为零原则,氮化镁化学式是Mg3N2;
②镁条除了能与氮气反应,还可以在二氧化碳气体中燃烧生成碳和氧化镁,该反应的化学方程式∶2Mg+CO2 ![]() 2MgO+C。【验证实验】用坩埚钳夹持镁条,点燃后迅速伸入盛有氮气的集气瓶中,镁条燃烧,发出暗红色火焰,生成淡黄色粉末,并放出大量的热。【得出结论】镁条能在氮气中燃烧生成固体氮化镁。【实验反思】用于测定空气中氧气含量所选用的药品,应符合的条件是只与空气中的氧气发生反应,生成物只能是固体。
2MgO+C。【验证实验】用坩埚钳夹持镁条,点燃后迅速伸入盛有氮气的集气瓶中,镁条燃烧,发出暗红色火焰,生成淡黄色粉末,并放出大量的热。【得出结论】镁条能在氮气中燃烧生成固体氮化镁。【实验反思】用于测定空气中氧气含量所选用的药品,应符合的条件是只与空气中的氧气发生反应,生成物只能是固体。
点睛∶这是一道实验探究题,主要探究通过实验测定空气中氧气的含量,本实验成功的关键①装置气密性良好②反应物过量,生成物只能是固体③冷却后测量。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案