题目内容
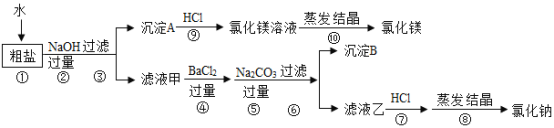
【题目】20℃时,将50g NaCl固体加入到盛有100g水的烧杯中,充分溶解得到溶液。
下列说法正确的是
温度/℃ | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
A.烧杯中剩余固体的质量为14g
B.烧杯中溶液的质量为150g
C.溶液中溶质质量分数的计算式为![]()
D.溶解操作时不需要玻璃棒
【答案】A
【解析】
根据溶解度的定义、溶质质量分数计算公式进行分析解答。
A、20℃时氯化钠的溶解度是36g,说明此温度下100g水中能溶解36g的氯化钠,未溶解的氯化钠质量为14g,A表述正确;
B、20℃时100g水中只能溶解36g的氯化钠,所以此时溶液的质量为136g,B表述错误;
C、20℃时溶液中溶质质量分数的计算式为![]() ,C表述错误;
,C表述错误;
D、溶解时玻璃棒的作用是搅拌加速固体溶解,D表述错误;
故选A。

练习册系列答案
相关题目
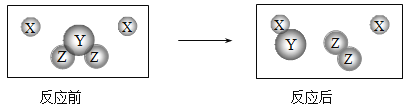
【题目】如图所示,在一只烧杯中进行实验。
请补全实验方案
序号 | 目的 | 步骤 |
A | 检验NaCl中混有Na2CO3 | ①加入少量样品;②加入适量水至全部溶解; ③加入______ |
B | 验证NaCl不能无限溶解 | 20°C时①加入100g水;②加入10gNaCl; ③加入_____(已知:20℃时,NaCl的溶解度为36g) |
C | 配制_____ | 加入5gNaCl;②加入95g水;③搅拌至全部溶解 |