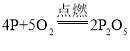题目内容
【题目】将质量为m的氧化铜粉末加入到100g14%的稀硫酸中,微热至氧化铜全部溶解,再向该蓝色溶液中加入10g铁粉,充分反应后,过滤,得滤液和5.2g滤渣。求:
(1)氧化铜的质量m的值。
(2)最后得到的滤液中溶质的质量分数。(最后结果精确到0.1%)
【答案】(1)4g;(2)20.0%
【解析】
根据氧化铜和稀硫酸反应生成硫酸铜和水、铁和硫酸铜反应生成硫酸亚铁和铜、铁和稀硫酸反应生成硫酸亚铁和氢气,进行分析计算。
(1)根据化学反应方程式:
![]() 、
、![]() 、
、![]()
可以分析出反应后溶液中的溶质全部为硫酸亚铁,反应的硫酸全部转化生成硫酸亚铁,根据铁、硫酸的质量关系,设消耗的铁的质量为![]()
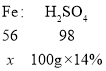
![]()
![]() =8g
=8g
所以,滤渣中铁的质量=10g-8g=2g
滤渣中铜的质量=5.2g-2g=3.2g
滤渣中铜元素的质量与氧化铜中铜元素的质量相等,
即:m×![]() ×100%=3.2g
×100%=3.2g
m=4g
(2)反应的硫酸全部转化生成硫酸亚铁,根据铁、硫酸的质量关系,设溶液中的溶质FeSO4的质量为![]()
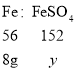
![]()
![]() =21.7g
=21.7g
设生成的水的质量为![]()
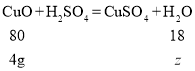
![]()
![]() =0.9g
=0.9g
最后得到的滤液中溶质的质量分数为:
![]() =20.0%
=20.0%

【题目】20℃时,将50g NaCl固体加入到盛有100g水的烧杯中,充分溶解得到溶液。
下列说法正确的是
温度/℃ | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
A.烧杯中剩余固体的质量为14g
B.烧杯中溶液的质量为150g
C.溶液中溶质质量分数的计算式为![]()
D.溶解操作时不需要玻璃棒
【题目】图中连线两端的物质在通常情况下可以相互反应。下列四组选项中,符合该图要求的是( )

① | ② | ③ | ④ | ⑤ | ⑥ | |
A | CO2 | NaOH溶液 | 稀HCl溶液 | Ca(OH)2溶液 | CuCl2溶液 | Fe |
B | CaO | 稀HCl溶液 | Fe | 稀H2SO4溶液 | Na2CO3溶液 | Ca(OH)2溶液 |
C | Fe | 稀H2SO4溶液 | BaCl2溶液 | Cu(NO3)2溶液 | Ca(OH)2溶液 | Na2CO3溶液 |
D | Zn | 稀HCl溶液 | CaCO3 | CuSO4溶液 | NaOH溶液 | FeCl3溶液 |
A.AB.