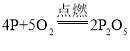题目内容
【题目】海洋是个巨大的宝库,能给我们提供很多的能量和物质。
(1)2017年开采成功的可燃冰其主要成分为甲烷,实验室可以用无水醋酸钠(CH3COONa)和碱石灰混合加热的方法来制取该气体。
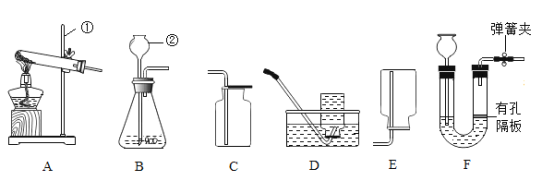
I、制取甲烷时应选择的发生装置为_____。
II、写出实验室制取甲烷的化学方程式_____。
III、若选择D收集甲烷,结束时,先把导管从水中取出的原因_____。
(2)从海水中获得的粗盐中含有NaCl、MgCl2、CaCl2、Na2SO4、泥沙等物质,粗盐中的难溶性杂质去除之后可获得精盐,为了从中提取氯化镁和氯化钠,设计实验方案如下:
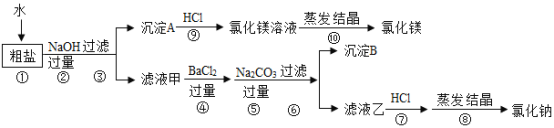
I、写出步骤⑨中反应的化学方程式_____。
II、步骤④⑤的顺序颠倒会导致什么后果?_____。
III、在步骤⑦中若加入的盐酸略过量是否对实验结果有影响,原因是什么?_____。
(3)用上面(2)中得到的精盐配制500g质量分数为0.9%的生理盐水,需要精盐的质量为_____,小明同学在量取水时俯视读数,他所配制的溶液的质量分数_____0.9%(填“>”“<”“=”)
(4)已知氯化镁固体电解可以得到单质镁和氯气,要制得96Kg的金属镁,需要氯化镁固体的质量为多少。_____
【答案】A ![]() 防止水槽中的水倒吸进试管,使试管因骤然冷却而炸裂
防止水槽中的水倒吸进试管,使试管因骤然冷却而炸裂 ![]() 会使氯化钠中出现BaCl2杂质无法除去 无影响,因为在蒸发过程中盐酸会以氯化氢气体的形式挥发出去 4.5g > 380kg
会使氯化钠中出现BaCl2杂质无法除去 无影响,因为在蒸发过程中盐酸会以氯化氢气体的形式挥发出去 4.5g > 380kg
【解析】
(1)I、实验室用无水醋酸钠固体和固体碱石灰加热制取甲烷气体,反应物的状态是固体,反应条件是加热,应用装置A;
II、实验室用CH3COONa和碱石灰在加热的条件下制取甲烷,反应的化学方程式为:![]() ;
;
III、若用排水法收集甲烷,实验结束时,先把导管从水槽中移处,再熄灭酒精灯,是为了防止水槽中的水倒吸,引起试管炸裂;
(2)I、步骤⑨中反应物是氢氧化镁和盐酸,生成物是氯化镁和水,所以方程式是:Mg(OH)2+2HCl═MgCl2+2H2O;
II、加入的氯化钡用来除去Na2SO4,加入的碳酸钠用来除去CaCl2和过量的氯化钡;加入的碳酸钠溶液应该放在氯化钡溶液之后,否则多余的氯化钡无法除去;
III、盐酸过量对结果无影响,因为盐酸加热时,氯化氢会蒸发掉;
(3)配制500g质量分数为0.9%的生理盐水,需要精盐的质量为500g![]() 0.9%=4.5g,量取水时俯视读数,实际量取水的体积小于要量取的水的体积,则所配制的氯化钠溶液的溶质质量分数将偏大;
0.9%=4.5g,量取水时俯视读数,实际量取水的体积小于要量取的水的体积,则所配制的氯化钠溶液的溶质质量分数将偏大;
(4)设需要氯化镁固体的质量为x,
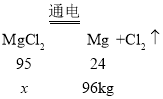
![]()
x=380kg。

【题目】20℃时,将50g NaCl固体加入到盛有100g水的烧杯中,充分溶解得到溶液。
下列说法正确的是
温度/℃ | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
A.烧杯中剩余固体的质量为14g
B.烧杯中溶液的质量为150g
C.溶液中溶质质量分数的计算式为![]()
D.溶解操作时不需要玻璃棒
【题目】图中连线两端的物质在通常情况下可以相互反应。下列四组选项中,符合该图要求的是( )

① | ② | ③ | ④ | ⑤ | ⑥ | |
A | CO2 | NaOH溶液 | 稀HCl溶液 | Ca(OH)2溶液 | CuCl2溶液 | Fe |
B | CaO | 稀HCl溶液 | Fe | 稀H2SO4溶液 | Na2CO3溶液 | Ca(OH)2溶液 |
C | Fe | 稀H2SO4溶液 | BaCl2溶液 | Cu(NO3)2溶液 | Ca(OH)2溶液 | Na2CO3溶液 |
D | Zn | 稀HCl溶液 | CaCO3 | CuSO4溶液 | NaOH溶液 | FeCl3溶液 |
A.AB.
【题目】Mg(OH)2具有广泛的应用,常用菱镁矿制备。研究人员向一定质量的菱镁矿粉中加入过量的稀硫酸,充分溶解后除杂、过滤,得到只含 MgSO4和 H2SO4的混合溶液,为确定混合溶液中镁的含量,取 4 份混合溶液各 100g,向每份混合溶液中加入一定质量的 4% NaOH溶液,得到实验数据如下表所示:
实验编号 | ① | ② | ③ | ④ |
NaOH 溶液质量/g | 10.0 | 20.0 | 30.0 | 40.0 |
Mg(OH)2质量/g | 0.232 | 0.522 | 0.580 | 0.580 |
(1)实验 (填实验编号)中硫酸镁完全反应。
(2)计算 100g 混合溶液中含 MgSO4的质量(写出计算过程)