题目内容
【题目】综合利用海洋资源
(1)综合利用海洋资源将是未来的发展趋势,如图是某设计院设计的综合利用海水的流程图。据图回答问题:
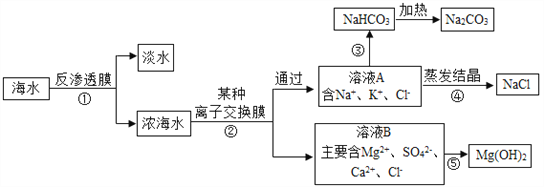
(1)步骤①是从海水中获得淡水的过程,工业上常采用的方法是膜法或多级闪急蒸馏法,分别是利用了混合体系中各物质的_____或_________不同进行分离。证明所得淡水中不含氯化钠的化学方法是__________________________________。
(2)过程②中“某种离子交换膜”可以使带一个单位电荷的离子透过。从而除去浓海水中的Mg2+、SO42﹣、Ca2+,若用化学沉淀法依次除去Mg2+、SO42﹣、Ca2+,需要的三种离子分别是____________(写离子符号)。
(3)过程③是氨碱法制纯碱的一个流程,需要向饱和食盐水中先后加入的两种物质是______________(写化学式)。该过程中发生反应的化学方程式___________________。
(4)过程④采用蒸发结晶的方法获得氯化钠,而不采用冷却热饱和溶液的方法,是因为__________________。溶液A中含有的氯化钾,可作为肥料,当农作物________(填序号)时可使用。
A.叶色不浓绿 B.茎杆不粗壮 C.根系不发达
(5)如果要充分利用海边的贝壳资源,过程⑤生成氢氧化镁的化学方程式是_____________,该反应的基本类型是___________。
(6)2017年5月18日,在我国南海海域实现可燃冰试采成功。
① 可燃冰中,水分子形成一种空间笼状结构(如图),甲烷和少量N2、CO2等分子填入笼内空隙中,无固定的化学计量关系,因此可燃冰属于____________(选填“纯净物”或“混合物”)。

②可燃冰中的甲烷属于_________(选填“有机物”或“无机物”)。写出甲烷完全燃烧的化学方程式 _________________。
③ 有专家指出,“从实现可燃冰试开采成功到大规模开采之路依然遥远,许多问题有待进一步解决”。下列证据中,支持专家观点的有_________________。
A.可燃冰存在于低温与高压环境,稳定性较差。大规模开采时,稍有不慎,易导致大量气体泄漏,会加剧温室效应
B.可燃冰是高效、资源量大的优质能源,开采可燃冰对我国能源生产有重要价值
C.可燃冰埋藏在海面下600~2000米深,虽然存储总量很大,但分布较为分散,目前开采难度很大
D.我国已实现可燃冰全流程试采核心技术的重大突破,形成了国际领先的新型试采工艺
E.可燃冰与煤、石油等能源相比,是绿色清洁能源,具有良好的商业开发前景
(7)海洋为我们提供了营养丰富的食材,海带富含的_______可以预防甲状腺肿大。
【答案】 颗粒大小 沸点 取样品,加入硝酸银溶液,不产生白色沉淀 OH-、Ba2+、CO32- NH3 、CO2 NH3+CO2+ H2O+ NaCl= NaHCO3+NH4Cl 氯化钠的溶解度受温度影响较小 B Ca(OH)2+MgSO4=Mg(OH)2↓+ CaSO4 复分解反应 混合物 有机物 CH4+2O2![]() CO2+2H2O AC 碘(或碘元素)
CO2+2H2O AC 碘(或碘元素)
【解析】(1)反渗透膜法与滤纸过滤法在原理上都是利用混合体系中各物质的颗粒大小或沸点的不同进行分离的方法;证明所得淡水中不含氯化钠的化学方法是:取样品,加入硝酸银溶液,不产生白色沉淀;(2)除去杂质离子的同时,不能带入新的杂质离子,所以除镁离子用氢氧化钠溶液中的氢氧根离子;除硫酸根离子用氯化钡溶液中的钡离子;除钙离子与前面过量的钡离子用碳酸钠溶液中的碳酸根离子;(3)过程③是向饱和食盐水中先通入氨气,再通入二氧化碳,得到碳酸氢钠和氯化铵;该过程中发生反应的化学方程式:NH3+CO2+ H2O+ NaCl= NaHCO3+NH4Cl;(4)过程④采用蒸发结晶的方法,而不采用冷却热饱和溶液方法,原因是氯化钠的溶解度受温度的影响较小;溶液A中含有的氯化钾,可作为肥料,可使农作物茎杆粗壮;(5)过程⑤中生成氢氧化镁的化学方程式为:Ca(OH)2+MgSO4=Mg(OH)2↓+ CaSO4,此反应属于复分解反应;(6)①甲烷和少量N2、CO2等分子填入笼内空隙中,无固定的化学计量关系,因此可燃冰属于混合物;②甲烷是最简单的有机物;甲烷完全燃烧的化学方程式:CH4+2O2![]() CO2+2H2O;③A、可燃冰存在于低温与高压环境,稳定性较差,大规模开采时,稍有不慎,海底沉积物会失去稳定,可能引发海底塌方,甚至导致海啸,符合题意;B、可燃冰是高效、资源量大的优质能源,开采可燃冰对我国能源生产有重要价值,不合题意;C、可燃冰埋藏在海面下600-2000米深,虽然存储总量很大,但分布比较分散,目前开采难度大,符合题意;D、我国已实现可燃冰全流程试采核心技术的重大突破,形成了国际领先的新型试采工艺,不合题意;E、可燃冰与煤、石油等能源相比,是绿色清洁能源,具有良好的商业开发前景,不合题意。故选AC;(7) 海带富含的碘元素可以预防甲状腺肿大。
CO2+2H2O;③A、可燃冰存在于低温与高压环境,稳定性较差,大规模开采时,稍有不慎,海底沉积物会失去稳定,可能引发海底塌方,甚至导致海啸,符合题意;B、可燃冰是高效、资源量大的优质能源,开采可燃冰对我国能源生产有重要价值,不合题意;C、可燃冰埋藏在海面下600-2000米深,虽然存储总量很大,但分布比较分散,目前开采难度大,符合题意;D、我国已实现可燃冰全流程试采核心技术的重大突破,形成了国际领先的新型试采工艺,不合题意;E、可燃冰与煤、石油等能源相比,是绿色清洁能源,具有良好的商业开发前景,不合题意。故选AC;(7) 海带富含的碘元素可以预防甲状腺肿大。

 走进文言文系列答案
走进文言文系列答案【题目】探究醋蛋液
食用醋蛋液可以补充人体所需营养,做法(如图):将洗净的鸡蛋放入盛有7°白醋的玻璃杯中,放置3天左右,用筷子将蛋清与蛋黄打散即可。

【查阅资料】食醋的主要成分为醋酸 (CH3COOH),醋酸在水中能解离出H+和CH3COO-。
【提出问题】
I.产生的气体是什么?
小英按照制作说明进行操作,把鸡蛋放入白醋中,观察到蛋壳逐渐溶解,表面有大量气泡产生,她对产生的气体进行了如下猜想:
【猜想与假设】
猜想1:二氧化碳
猜想2:氢气
猜想3:甲烷
(1)小英运用的观察方法是_______(填“直接”或“间接”)观察,小英在观察的基础上作出以上猜想的理论依据是_________________________________。
(2)假设是利用已有的知识和经验进行加工处理形成的一种能被检验的假设性结论,其表述方式为:如果……,那么……。针对以上任一种猜想做出你的假设______________。
【获得结论】实验证明,产生的气体为二氧化碳。
【反思与交流】
(3)将鸡蛋放入白醋中,蛋壳中的碳酸钙和醋酸作用生成可溶性的___________(填化学式),可以补充人体所需钙元素。除蛋白质外,醋蛋液中含钙、铁、锌、磷、钾等多种人体必需的元素,其中属于微量元素的有_______________(写元素符号)。
(4)醋蛋液中的蛋白质主要来自鸡蛋清,证明蛋清中富含蛋白质的方法是_________。
II.醋蛋液中是否含有醋酸?
【实验探究】小英同学通过测定醋蛋液的酸碱度来确定其中是否含有醋酸,请将下表填写完整。
实验操作 | 实验现象及结论 |
_______________________________________。 | 现象:_________________ 。 结论:醋蛋液中含有醋酸。 |
【反思与交流】
制得的醋蛋液中如果有过量的醋酸会灼伤、腐蚀食道黏膜及损伤脾胃,食用时可加一定量的水进行稀释,加水稀释过程中醋蛋液的pH ___________(填“增大”,“减小”或“不变”)。