��Ŀ����
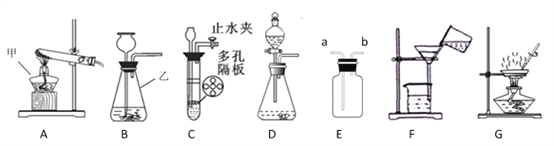
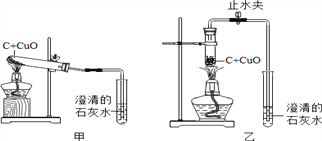
����Ŀ��ij��ѧ��ȤС�鰴�տα�ʵ�鷽������ͼ�ף�����ľ̿������ͭ��Ӧʵ��ʱ�����ֺ��ѹ۲쵽�Ϻ�ɫͭ�����ɣ�ȴ�����а���ɫ������֡����Ǿ��������ʵ�����̽���Ľ���
��������⡿
����ɫ�Ĺ�����ʲô�����ѡ����ʵ�������ʹľ̿��ԭ����ͭ��ʵ����������ԣ�
���������ϡ�
ͭ��+1��+2���ֻ��ϼۣ�ͨ������£����Ļ��ϼ�Ϊ��2��̼�Ļ��ϼ�Ϊ+2��+4��
����������衿
��1��ͬѧ����Ϊ���ְ���ɫ���������һ�ֻ�������Ļ�ѧʽΪ_______��
��2��ͬѧ�ǻ���Ϊ��ͨ���ı䷴Ӧ���״̬�������ȣ��Լ���Ӧװ�ã�����ʹ��ʵ������������ԣ����ٳ��ְ���ɫ����������
�������뽻����
��3��С��ͬѧ�����ó�ϸ̿��������ͭ��ĩ����ʵ�顣ԭ����______��
��4����������������ͭ��̼������������С������ѡ��______����ѡ����ţ��ı�����
A. 40��4 B. 40��3 C. 40��2
����ΪС������ѡ���������_______________��
��ʵ������ۡ�
ͬѧ�Ǿ������Ľ���ķ�������ʵ�飬�����ڼ�������װ�õ������Ժ����Թ��м����Ѹ����ҩƷ����ʼ���ȣ������������ʯ��ˮ�ճ��ֻ���ʱ��______����ܡ� ���ܡ���ȷ������ͭ��̿���Ѿ���ʼ��Ӧ�����ã����ɿ����Թܵײ�����ȣ�ֹͣ���Ⱥ����ܿ��������������Թܵײ����¶������ӣ��������˵���÷�Ӧ��___________��Ӧ������ȡ����ȡ�����
��6������Ӧ�������Ƚ������ܴ�ʯ��ˮ��ȡ����Ȼ��ر�ֹˮ�У��ò�����Ȼ��ȴ�������ر�ֹˮ�У����ܳ��ֵ�������____________����������ȴ��ͬѧ�������ҵ����ڴ��Ѿõ��Ϻ�ɫͭ�飬ʵ������Բ���ɹ���
���𰸡� Cu2O ����Ӧ��ĽӴ������ʹ��Ӧ���졢����� A ��Ӧ��̿�ۻ����Թ��ڿ����е�������Ӧ�����������ģ������Թ�����̿�������ڷ�Ӧ���� ���� ���� ����������Թ��У�ʹ���ɵ���Ȼ���ȵ�ͭ���±�����
��������������Ҫ�������ʵ����ʣ����ʱҪ���ݸ������ʵ����ʣ���ϸ������������з������жϣ��Ӷ��ó���ȷ�Ľ�����
��1�����ְ���ɫ���������������ͭ��������ͭ�Ļ�ѧʽ��Cu2O��
��3��С��ͬѧ�����ó�ϸ̿��������ͭ��ĩ����ʵ�飻ԭ���������˷�Ӧ��Ӵ��������Ӧ����֣�
��4������ͭ��̼�۷�Ӧ�Ļ�ѧ����ʽ����������ϵΪ��2CuO+C![]() 2Cu+CO2����
2Cu+CO2����
160 12
����ͭ��̼��������Ϊ��160��12=40��3����Ӧ��̿�ۻ����Թ��ڿ����е�������Ӧ�����������ģ������Թ�����̿�������ڷ�Ӧ���У�����ͭ��̼�۵���������Ӧ��ѡ��40��4����ѡA��
��5�����Թ��м����Ѹ����ҩƷ����ʼ���ȣ������������ʯ��ˮ�ճ��ֻ���ʱ������ȷ������ͭ��̼���Ѿ���ʼ��Ӧ��������Ϊ���ɵĶ�����̼������̼���Թ��е�������Ӧ���ɵģ����ã����ɿ����Թܵײ�����ȣ�ֹͣ���Ⱥ����ܿ��������������Թܵײ����¶������ӣ��������˵���÷�Ӧ�Ƿ��ȷ�Ӧ��
��6������Ӧ�������Ƚ������ܴ�ʯ��ˮ��ȡ����Ȼ��ر�ֹˮ�У��ò�����Ȼ��ȴ�������ر�ֹˮ�У����ܳ��ֵ������ǿ���������Թ��У�ʹ���ɵ���Ȼ���ȵ�ͭ���±�������