题目内容
【题目】某食用纯碱中含有少量的氯化钠,为测定该纯碱中碳酸钠(Na2CO3)的含量,现取该纯碱样品12.5 g,加入150.0 g稀盐酸溶液恰好完全反应,测得反应后溶液总质量变成158.1 g。请计算:
(1)反应中产生CO2的质量为_________ 克。
(2)纯碱样品中Na2CO3的质量分数___________。
【答案】 4.4克 84.8%
【解析】
试题(1)根据质量守恒定律,生成二氧化碳的质量为:(12.5g +150.0g)-158.1g=4.4g
(2)设纯碱样品中Na2CO3的质量分数为x
Na2CO3+2HCl==2NaCl+CO2↑+H2O
106 44
12.5g×x 4.4g
![]() =
=![]() 解得x=84.8%
解得x=84.8%
答:(1)反应中产生二氧化碳的质量为4.4g (2)纯碱样品中Na2CO3的质量分数为84.8%

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】学习了二氧化锰对过氧化氢有催化作用的知识后。某同学想:氧化铜能否起到类似二氧化锰的催化剂作用呢?于是进行了如下探究。
(猜想)Ⅰ.氧化铜不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ.氧化铜参与反应产生氧气,反应前后质量和化学性质发生了改变;
Ⅲ.氧化铜是反应的催化剂,反应前后_____和_____不变。
(实验)用天平称量0.2g氧化铜,取5mL 5%的过氧化氢溶液于试管中,进行如下实验:
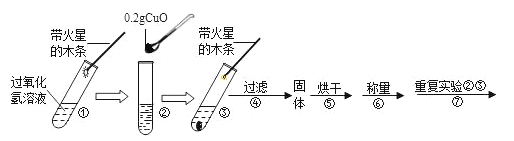
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
_____, 带火星的木条复燃 | 所得固体 _____g | 溶液中有气泡放出, _____ | 猜想Ⅰ、Ⅱ不成立 猜想Ⅲ成立 |
(2)步骤①的目的是_____。
(3)过氧化氢能被氧化铜催化分解放出氧气的化学反应的文字表达式为_____。
【题目】化学小组的同学在做镁条在空气中燃烧实验时,发现生成的白色固体中还夹杂着少量的淡黄色的固体。
【提出问题】为什么会生成淡黄色固体?
【查阅资料】记录了下列几种物质的颜色:
物质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
颜色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 | 白色 |
小红同学认为不必查阅氯化镁的颜色,理由是:________________________。
【提出猜想】分析资料小红认为淡黄色固体可能是和空气中的__________反应生成的。
【实验探究】小红设计实验来验证自己的猜想,他的方案可能是:__________。
【实验结论】根据小红的实验结果,写出镁条在空气中燃烧的两个化学反应方程式:
①_______________________________; ②______________________________。