题目内容
【题目】如图所示,在白色点滴板1~6的孔穴中,分别滴加2滴稀盐酸。
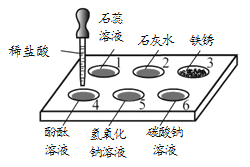
(1)无明显变化的孔穴有________(填孔穴序号)。
(2)孔穴3中发生反应的化学方程式为________。
(3)孔穴5反应后溶液中的溶质是_______(写出所有可能)。
【答案】2、4、5 Fe2O3+6HCl===2FeCl3+3H2ONaCl; NaCl、HCl; NaCl、NaOH
【解析】
(1)石蕊溶液遇到稀盐酸变红;稀盐酸和石灰水反应生成氯化钙和水,没有明显现象;铁锈遇到稀盐酸,会逐渐溶解并生成氯化铁,溶液变成黄色;酚酞溶液遇到稀盐酸不变色;稀盐酸和氢氧化钠溶液反应生成氯化钠和水,没有明显现象;稀盐酸和碳酸钠溶液反应生成氯化钠、二氧化碳和水,有气泡产生;(2)铁锈和稀盐酸反应生成氯化铁和水,反应的化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O;(3)稀盐酸和氢氧化钠溶液反应生成氯化钠和水,若两者恰好完全反应,反应后溶液中的溶质只有氯化钠;若盐酸剩余,反应后溶液中的溶质有氯化钠、氯化氢;若氢氧化钠剩余,反应后溶液中的溶质有氯化钠、氢氧化钠。

 期末集结号系列答案
期末集结号系列答案【题目】维生素C又名抗坏血酸,它能增强人体对疾病的抵抗能力。某化学学习小组对其进行如下研究:
(查阅资料)维生素C常温下为白色晶体,易与氧气、高锰酸钾等物质反应。
Ⅰ.探究维生素C的性质
(进行实验)
实验序号 | 1-1 | 1-2 | 1-3 | 1-4 |
操作 |
|
|
|
|
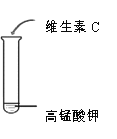
现象 | 白色固体消失,形成溶液 | 溶液变为红色 | …… | 紫色溶液褪色 |
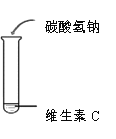
结论 | …… | 维生素C溶液为酸性 | 维生素C能与 碳酸氢钠反应 | 维生素C能与高锰酸钾反应使其溶液褪色 |
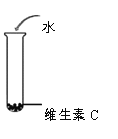
(1)由实验1-1现象推测维生素C具有的物理性质是______。
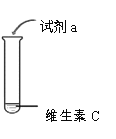
(2)实验1-2中使用的试剂a为_________(填序号,下同)。
A.紫色石蕊试液 B.无色酚酞试液 C.氢氧化钠溶液
(3)实验1-3中实验现象为__________。
Ⅱ.测定食品中维生素C的含量
(进行实验)
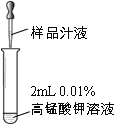
实验序号 | 2-1 | 2-2 | 2-3 | 2-4 | 2-5 | |
实验操作 |
| 鲜榨的猕猴桃汁 | 鲜榨的橙汁 | 鲜榨的西红柿汁 | 加热后冷却至室温的鲜榨西红柿汁 | 放置12小时的西红柿汁 |
紫色溶液褪色时所滴加的样品滴数 | 6 | 8 | 11 | 14 | …… | |
(解释与结论)
(4)实验2-1至2-4中,维生素C的含量最高的是___________。
(5)由实验2-1至2-4可知,影响食品中维生素C含量的因素有_________。
(6)请你推测实验2-5中,紫色溶液褪色时的样品滴数可能为_________。
A.9 B.11 C.15
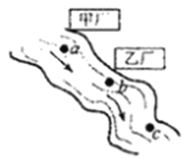
【题目】NH4Cl和Na2SO4的溶解度表及溶解度曲线如图.下列说法错误的是( )

温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度S/g | NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 60.2 |
Na2SO4 | 9.6 | 20.2 | 40.8 | 48.4 | 47.5 | 47.0 | |
A. 乙为NH4Cl
B. t3应介于40℃﹣50℃
C. 55℃时,分别将两饱和溶液蒸发等质量的水,得到固体质量甲>乙
D. 等质量的甲、乙饱和溶液从t3降温到t1,析出的晶体质量相等