题目内容
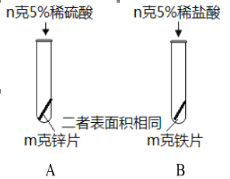
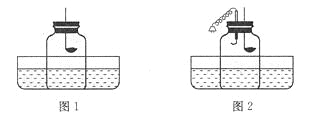
【题目】下图为某小组探究金属化学性质的两组实验。
实验I | 实验II |
|
|
①实验I中以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,你认为是否合理_____(填“是”“否”),理由是_____;
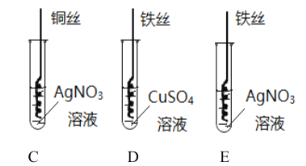
②写出实验II中C试管内反应的化学方程式_____;
③D试管中充分反应后,溶液质量_____(填“增大”“减小”“不变”);
④实验II中要验证![]() 的金属活动性顺序,至少要做的实验是_____(填字母序号)。
的金属活动性顺序,至少要做的实验是_____(填字母序号)。
【答案】否 选取的酸的种类不同 Cu+2AgNO3═Cu(NO3)2+2Ag 减小 CD
【解析】
①从图可以看出实验I选取的酸的种类不同,因此以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱不够合理;
②实验Ⅱ中C试管内反应的化学方程式为Cu+2AgNO3═Cu(NO3)2+2Ag;
③根据铁与硝酸铜反应的方程式:Fe+Cu(NO3)2═Cu+Fe(NO3)2.可知56份质量的铁可以置换出64份质量的铜,所以反应后溶液质量比反应前减小。
④用于证明铁、铜、银的金属活动性顺序实验是:CD,因为由C可知,铜能置换出硝酸银中的银,说明活动性铜>银,D中的铁能置换出硫酸铜中的铜,说明活动性铁>铜,所以可得活动性:铁>铜>银,故选CD;

练习册系列答案
相关题目