题目内容
【题目】某银白色固体A在氧气中燃烧,火星四射,生成黑色固体B;如果把A放入稀盐酸中,则生成浅绿色的溶液C和气体D,把A投入蓝色溶液E中,发现A表面覆盖一层红色物质F,请按要求回答下列问题:
(1)写出A、B、D的化学式:A_____,B_____,D_____。
(2)写出下列反应的化学方程式:
①A燃烧_____;
②A与稀盐酸反应_____;
③A与E反应_____。
【答案】Fe Fe3O4 H2 3Fe+2O2![]() Fe3O4 Fe+2HCl=FeCl2+H2↑ Fe+CuSO4=FeSO4=Cu
Fe3O4 Fe+2HCl=FeCl2+H2↑ Fe+CuSO4=FeSO4=Cu
【解析】
本题主要考察常见物质的相互反应,以及推理能力
能在氧气中燃烧,火星四射的物质A是铁,产生的黑色固体B是四氧化三铁,铁与稀盐酸反应能产生浅绿色氯化亚铁溶液C和氢气D,将铁放入硫酸铜蓝色的溶液中,有红色物质F铜出现

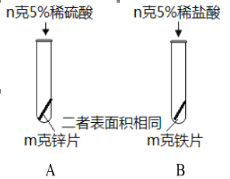
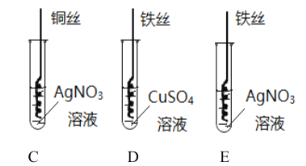
【题目】下图为某小组探究金属化学性质的两组实验。
实验I | 实验II |
|
|
①实验I中以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,你认为是否合理_____(填“是”“否”),理由是_____;
②写出实验II中C试管内反应的化学方程式_____;
③D试管中充分反应后,溶液质量_____(填“增大”“减小”“不变”);
④实验II中要验证![]() 的金属活动性顺序,至少要做的实验是_____(填字母序号)。
的金属活动性顺序,至少要做的实验是_____(填字母序号)。
【题目】马英同学取某地石灰石样品25g进行测定实验,现将200g稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如下表所示:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入稀盐酸的质量/g | 40 | 40 | 40 | 40 | 40 |
生成气体的总质量/g | 2.2 | 4.4 | m | 8.8 | 8.8 |
试求:(1)m的值为 _____________________g。
(2)石灰石样品中碳酸钙的质量等于__________________ g。
(3)所加盐酸的溶质质量分数_______________?(写出计算过程,计算结果精确至0.1)