题目内容
【题目】多角度地认识溶液,有助于我们更好地了解其在生产生活中的重要作用。
(1)将生石灰与足量的水混合,充分搅拌后静置。上层清液为澄清石灰水,属于_______________;下层未完全溶液的部分未石灰乳,属于_______________。
A溶液 B悬浊液 C乳浊液
(2)不能用于说明![]() ,溶液是均一、稳定的是____________。
,溶液是均一、稳定的是____________。
A溶液各部分颜色相同 B溶液各部分溶质质量分数相同
C溶液久置后颜色不变 D滴入![]() 溶液有蓝色沉淀生成
溶液有蓝色沉淀生成
(3)将一定量的下列物质分别投入到100g水中充分溶解,计算所得溶液的溶质质量分数。
物质名称 | 投入质量 |
| 溶质质量分数 |
氯化钠 |
|
| _____ |
硝酸钾 |
|
| _____ |
胆矾 |
|
| _____ |
(4)20℃时,某物质在不同质量的水中溶解达到饱和时,溶质的质量与水的质量关系如图所示。
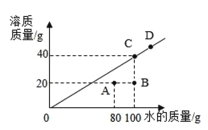
①![]() 时,该物质的溶解度是__________________溶质。
时,该物质的溶解度是__________________溶质。
②若D点对应的是120g水,则溶质质量为____________g
③如图可知溶液A点转变成B点状态,可通过增加溶剂(加20g水)的方式实现。则溶液从B点转变成C点状态,可通过_____________方式实现;
【答案】A B CD ![]()
![]()
![]() 40g/100g水 48 加20g溶质 C=D>A>B
40g/100g水 48 加20g溶质 C=D>A>B
【解析】
:(1)上层清液为澄清石灰水是均一的、稳定的混合物,属于溶液;下层未完全溶液的部分石灰乳不是均一的、稳定的,是悬浊液;
(2)CuSO溶液溶液各部分颜色相同、溶液各部分谘质质量分数相同、溶液久置后颜色不变说明它是均一的、稳定的;滴入NaOH溶液有蓝色沉淀生成,是硫酸铜溶液和氢氧化钠溶液的化学反应,故不能说明CuSO溶液是均一、稳定的,故选D;
(3)20℃时,NaCl的溶解度是36g,40g氯化钠投入100g水中,只能溶解36g,所以所得溶液溶质的质量分数=![]() ×100%=26.5%;
×100%=26.5%;
20℃时,硝酸钾的溶解度是31.6g,30g硝酸钾投入100g水中全部溶解,所以所得溶液溶质的质量分数=![]() ×100%=23.1%;
×100%=23.1%;
20℃时,胆矾的溶解度是32g,胆矾溶于水后溶液中的溶质是硫酸铜,且25g可以完全溶于水100g,所以所得溶液溶质的质量分数=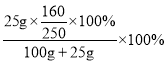 =12.8%;
=12.8%;
(4)①由图示可知,20℃时,该物质的溶解度是40g;
②设120g水中溶解溶质的质量为x时达到饱和。
![]()
x=48g
③根据溶解度的特点可知,溶液从B点转变成C点状态,可通过加20g溶质方式实现;
④根据图示知,由于图中的都是该温度下达到饱和时的溶质和溶剂情况,所以直线上的二个点的质量分数相等,而B点明显相对A点而言是,水多而溶质相同,所以质量分数A>B,C、D是饱和溶液,A、B是不饱和溶液,所以C、D溶质的质量分数大于A、B溶质的质量分数。所以A、B、C、D四点对应的溶液溶质质量分数大小关系是:C=D>A>B。
故答案为:
(1)A;B;
(2)D;
(3)26.5%;23.1%;12.8%;
(4)①40;
②48;
③过加20g溶质;
④C=D>A>B。