题目内容
【题目】计算题。硝酸铵是常见的氮肥。
(1)硝酸铵中含有_______种元素。
(2)写出硝酸铵的化学式并标明氮元素化合价___________。根据硝酸铵的化学式进行以下计算(写出计算过程)。
(3)硝酸铵的相对分子质量? _________
(4)硝酸铵中氮、氢、氧元素的质量比?_________
(5)硝酸铵中氧元素的质量分数? _________
(6)1.6kg硝酸铵固体中的含氮量与多少千克的硫酸铵中含氮量相当?_________
【答案】3 ![]() 80 7:1:12 60% 2.64Kg
80 7:1:12 60% 2.64Kg
【解析】
解:(1)硝酸铵是由氮、氢、氧三种元素组成的;
(2)元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,故写出硝酸铵的化学式并标出氮元素的化合价可表示为:![]() ;
;
(3)硝酸铵的相对分子质量为:14×2+1×4+16×3=80;
(4)硝酸铵中N、H、O元素的质量比为:(14×2):(1×4):(16×3)=7:1:12;
(5)硝酸铵中氧元素的质量分数为:![]() ×100%=60%;
×100%=60%;
(6)设硫酸铵的质量为x,则1.6kg×![]() ×100%=x×
×100%=x×![]() ×100%;x=2.64kg。
×100%;x=2.64kg。

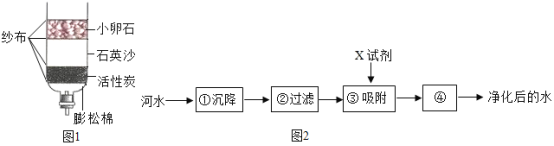
【题目】工业上用如下工艺流程获得较纯净细白的碳酸钙用作食品添加剂,(石灰石中的杂质高温不分解、不溶于水且不与盐酸反应;氢氧化钙与盐酸反应没有气泡产生)试回答:
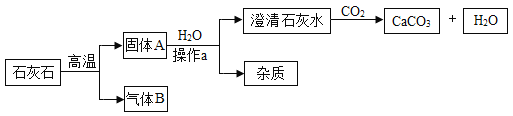
①石灰石高温分解的化学方程式是____________。
②为了节约成本,该工艺中可循环使用的物质是____________。
③有同学对流程中固体A的成分进行实验探究。
I.提出问题:石灰石中的碳酸钙是否完全分解了?
Ⅱ.进行猜想:①碳酸钙全部分解:②____________;③碳酸钙没有分解。
Ⅲ.设计实验方案、进行实验:
下表是对猜想①进行实验探究的过程:
实验步骤 | 实验现象 | 实验结论 |
取样,加适量水溶解,静置取少量上层清液于试管中,滴入酚酞试液;取少量下层固体于试管中,加入足量盐酸。 | 试液变为红色____________ | 碳酸钙全部分解 |
请你对猜想②进行探究,完成下表:
实验步骤 | 实验现象 | 实验结论 |
取样,加适量水溶解,静置,取少量上层清液于试管中,滴入酚酞试液;取少量下层固体于试管中,加入足量盐酸。 | ____________ | ____________ |
【题目】多角度地认识溶液,有助于我们更好地了解其在生产生活中的重要作用。
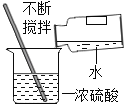
(1)将生石灰与足量的水混合,充分搅拌后静置。上层清液为澄清石灰水,属于_______________;下层未完全溶液的部分未石灰乳,属于_______________。
A溶液 B悬浊液 C乳浊液
(2)不能用于说明![]() ,溶液是均一、稳定的是____________。
,溶液是均一、稳定的是____________。
A溶液各部分颜色相同 B溶液各部分溶质质量分数相同
C溶液久置后颜色不变 D滴入![]() 溶液有蓝色沉淀生成
溶液有蓝色沉淀生成
(3)将一定量的下列物质分别投入到100g水中充分溶解,计算所得溶液的溶质质量分数。
物质名称 | 投入质量 |
| 溶质质量分数 |
氯化钠 |
|
| _____ |
硝酸钾 |
|
| _____ |
胆矾 |
|
| _____ |
(4)20℃时,某物质在不同质量的水中溶解达到饱和时,溶质的质量与水的质量关系如图所示。
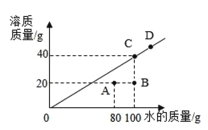
①![]() 时,该物质的溶解度是__________________溶质。
时,该物质的溶解度是__________________溶质。
②若D点对应的是120g水,则溶质质量为____________g
③如图可知溶液A点转变成B点状态,可通过增加溶剂(加20g水)的方式实现。则溶液从B点转变成C点状态,可通过_____________方式实现;