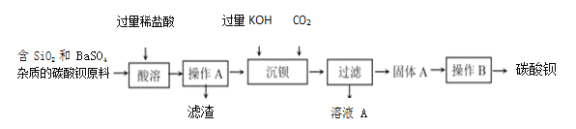
题目内容
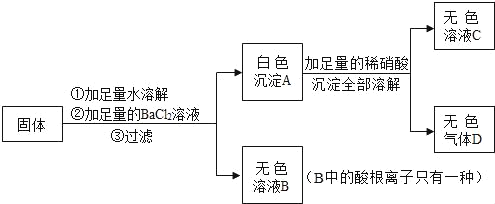
【题目】实验室有一包固体物质,可能含有氯化钠、硫酸钠、碳酸钾、硝酸钠和高锰酸钾中的一种或几种。为了确定该固体的成分,某化学小组的同学按下列框图进行实验。回答下列问题:

(1)该固体中一定没有___(写化学式)。
(2)根据实验现象分析,第①步所得无色溶液的pH____7(填“>”、“=”或“<”)。
(3)为了不干扰对第③和④步实验结论的判断,试剂A应选择____(写试剂名称)。
(4)第③步发生的化学反应方程式为___。
(5)最后滤液中的溶质有___种。
【答案】KMnO4 > 稀硝酸 Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3 5
【解析】
高锰酸钾溶于水呈紫红色的性质,可确定不含高锰酸钾,加入试剂A能得到无色无味的气体,说明A是酸,产生的气体是二氧化碳,故一定含有碳酸钾,为了不影响氯化钠和硫酸钠的检验,故加入的A是硝酸;加入足量的硝酸钡产生白色沉淀,说明含有硫酸钠,在加入硝酸银溶液产生白色沉淀,说明含有氯离子,据此分析解答。
(1)由分析可知,一定没有高锰酸钾,故填:KMnO4;
(2) 加入试剂A能得到无色无味的气体,说明A是酸,产生的气体是二氧化碳,故一定含有碳酸钾,碳酸钾溶液显碱性,第①步所得无色溶液的pH大于7,故填:>;
(3)由分析可知,为了不影响氯化钠和硫酸钠的检验,故加入的A是稀硝酸;
(4)第③步是硫酸钠与硝酸钡反应生成硫酸钡和硝酸钠,化学反应方程式为Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3。
(5)最后滤液中的溶质有过量的硝酸钡、硝酸银和稀硝酸,还有反应生成的硝酸钠、硝酸钾共5种。

【题目】把A、B、C、D四种物质放在密闭容器中,在一定条件下充分反应,并测得反应物和产物在反应前后各物质的质量如表所示:
物质 | A | B | C | D |
反应前质量 |
|
|
|
|
反应后质量 | 待测 |
| 0 |
|
下列说法正确的是![]()
A. 物质C一定是反应物,物质D可能是单质
B. 反应后密闭容器中A的质量为![]()
C. 反应过程中,物质B和物质D变化的质量比为87:36
D. 若物质A与物质C的相对分子质量之比为194:216,则反应中A和C的化学计量数之比为2:1