题目内容
【题目】将 10 克 CuO 粉末加入到 100 克一定质量分数的稀 H2SO4 溶液中,微热到 CuO 完全溶解,再向溶液中 加入 a 克铁粉,使溶液中的溶质完全反应后过滤,将滤渣在低温下烘干,得干燥固体质量仍然为 a 克,下列分析不正确的是
A.滤渣中一定含有 Cu,可能还有 Fe
B.加入铁粉后,有红色固体产生,还有少量气泡产生
C.a 的取值范围是:a≥8
D.稀 H2SO4 的溶质质量分数为 12.25%
【答案】D
【解析】
设与10g氧化铜反应的硫酸质量为x,消耗铁质量为y,生成铜质量为z。
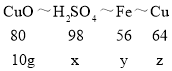
![]()
解得:x=12.25g,y=7g,z=8g。
因为生成了8g铜,当a=8时,则加入的铁粉应该是8g,与稀硫酸反应的铁粉质量:8g-7g=1g。
根据题意有:

稀硫酸质量分数:![]() ×100%=14%。
×100%=14%。
通过计算可知,稀硫酸质量分数是14%,当a>8时,仍有7g铁粉和硫酸铜反应,1g铁粉与稀硫酸反应,多出来的部分不参加反应,最终保留在滤渣中,滤渣中一定含有铜,可能含有铁,加入铁粉后析出红色固体,产生气泡,a的取值范围:a≥8,因此D选项说法不正确。
故选:D。

 高中必刷题系列答案
高中必刷题系列答案【题目】实验小组以鸡蛋壳(主要成分CaCO3,在水中能溶解出微量的Ca2+,其他成分对实验影响忽略不计)为牙齿的替代物,模拟含氟牙膏保护牙齿的化学原理。
(查阅资料)
①含氟牙膏保护牙齿的原因:含氟牙膏中的NaF能与牙齿表面溶解的微量Ca2+反应,生成更难溶于酸的物质CaF2。
②常温下,酚酞溶液遇pH<8.2的碱性溶液不变色。
(进行实验)
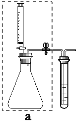
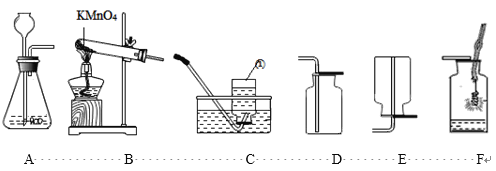
实验一:如图甲连接仪器,进行实验。
项目 | 实验组 | 对照组 |
锥形瓶中的物质 | 0.5g用含氟牙膏处理过的鸡蛋壳 | 0.5g未用含氟牙膏处理过的鸡蛋壳 |
注射器中的物质 | 20mL3.5%的盐酸 | m |
试管中的物质 | 滴有酚酞的氢氧化钠稀溶液 | 滴有酚酞的氢氧化钠稀溶液 |
试管中溶液褪色时间(s) | t1 | t2 |
|
|
|
甲 | 乙 | 丙 |
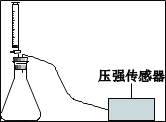
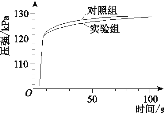
实验二:如图乙连接仪器,锥形瓶和注射器中的物质均与实验一相同。进行实验,测量压强随时间的变化如图丙所示。
(解释与结论)
(1)装入药品前,检查图甲装置a的气密性:用止水夹夹住右侧橡皮管,_______________,说明装置气密性良好。
(2)实验一中:①鸡蛋壳中主要成分与盐酸反应的化学方程式为__________________________。②m处应填写的是_______________。
(3)实验二能证明含氟牙膏对鸡蛋壳有保护作用,其理由是______________________________。由此推断出实验一中,t1 ______t2(填“>”、“<”或“=”)。
(反思与评价)
(4)作为牙膏常用的磨擦剂有:①CaCO3 ②SiO2(二氧化硅)③Al(OH)3 根据本实验模拟的含氟牙膏保护牙齿的化学原理,不能用于制作含氟牙膏磨擦剂的是______(填序号)。
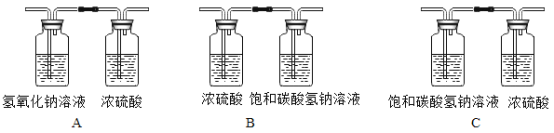
【题目】文献资料表明,某些金属与酸反应存在氯离子效应,即氯离子的存在能加快其反应速率。
(1)某化学小组为了探究氯离子效应,在室温下,进行了如下实验。
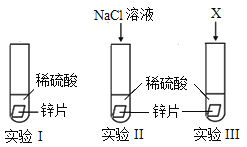
记录现象:实验II比实验I产生气泡快。
①实验I主要目的是_____,写出实验I中反应的化学方程式:_____。
②为了说明实验II中反应速率加快是氯离子效应,实验III中X是_____(填标号)。
a.Na2SO4溶液 b.Na2CO3溶液 c.NaOH溶液 d.H2O
③上述三个实验还应控制相同的条件是:_____(写两点)。
(2)为了进一步探究温度和氯离子对反应速率的影响,化学小组又在不同温度下进行了两组实验,数据如下表所示(表中“所用时间”是指锌与稀硫酸反应生成15mL氢气所用的时间)。
序号 | 温度环境(℃) | 未加入氯化钠所用时间(s) | 加入氯化钠所用时间(s) |
1 | 27 | 63 | 32 |
2 | 37 | 59 | 21 |
3 | 47 | 36 | 18 |
4 | 57 | 22 | 11 |
5 | 67 | 15 | 10 |
6 | 77 | t | 8 |
④表中数据可得出:温度升高,锌与稀硫酸的反应速率_____(填“变大”或“变小”)。
⑤表中t的数值范围是_____。
⑥由表中数据可知:温度升高,锌与稀硫酸反应的氯离子效应减弱,可能的原因是:_____。