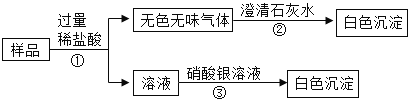
题目内容
【题目】海水的综合利用流程图如下:
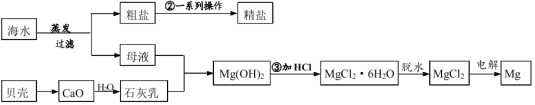
(一)利用海水制取精盐
(1)海水在阳光与风力作用下逐渐析出粗盐,该步骤类似于实验室的_______结晶。
(2)粗盐晶体中常常含有泥沙、CaCl2、MgSO4 杂质,一系列步骤包含溶解、加入化学试剂、过滤、用稀盐酸调节 pH 值至7,然后再蒸发结晶。其中加入的化学试剂必须过量其目的主要是_______。此时用____除CaCl2,用________除去 MgSO4。
(3)除去 CaCl2、MgSO4 从合理安排的角度来讲它们被除去的先后顺序为______。
A 先除 CaCl2 后除 MgSO4 B 先除 MgSO4 后除 CaCl2
(4)用稀盐酸调节 pH 等于 7 的目的是除去过量的杂质,所发生的化学反应基本类型是________。
A 中和反应 B 置换反应 C 复分解反应 B 化合反应
(二)镁的生产
(5)工业中用石灰乳与母液反应得到Mg(OH)2 一般不用澄清的石灰水,其原因是______ 。
(6)步骤③中通过观察到________现象证明稀 HCl 过量。
(7)电解熔融的氯化镁可以得到金属镁,此过程的反应方程式为_________。
【答案】蒸发 使杂质充分反应 碳酸钠 氢氧化钡 B C 石灰乳中的氢氧化钙含量高,能够消耗更多的氯化镁 固体全部溶解 MgCl2![]() Mg+Cl2↑
Mg+Cl2↑
【解析】
(1)海水在阳光与风力作用下,海水中的水分逐渐减少,因此析出粗盐,该步骤类似于实验室的蒸发结晶;故填:蒸发。
(2)除杂过程中加入试剂必须过量,其目的主要是使杂质充分反应;碳酸钠会与氯化钙反应生成碳酸钙沉淀和氯化钠、氢氧化钡会与硫酸镁反应生成氢氧化镁沉淀与硫酸钡沉淀,故用碳酸钠除去CaCl2,用氢氧化钡除去MgSO4。故填:使杂质充分反应;碳酸钠;氢氧化钡。
(3)碳酸钠会与氯化钙、氯化钡反应,所以碳酸钠必须放在氢氧化钡之后,碳酸钠不仅可以除去氯化钙,还可以除去多余的钡离子;故填:B。
(4)用稀盐酸调节pH等于7的目的是除去过量的杂质,就是盐酸除去过量的碳酸根离子和氢氧根离子,所发生的化学反应基本类型是复分解反应;故填:C。
(5)用石灰乳而不用澄清石灰水的原因是石灰乳中的氢氧化钙含量高,能够消耗更多的氯化镁,得到氢氧化镁的量更多。故填:石灰乳中的氢氧化钙含量高,能够消耗更多的氯化镁。
(6)白色氢氧化镁是不溶于水的固体,氢氧化镁与盐酸反应生成可溶于水的氯化镁和水,因此固体全部溶解即可说明盐酸已过量。故填:固体全部溶解。
(7)无水MgCl2电解制取Mg,同时生成氯气,反应的化学方程式为:MgCl2![]() Mg+Cl2↑。故填:MgCl2
Mg+Cl2↑。故填:MgCl2![]() Mg+Cl2↑。
Mg+Cl2↑。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案【题目】某同学通过查阅资料知道了牙膏的主要成分。将一定比例的碳酸钙粉末和食盐倒入小烧杯中,然后加入适量的甘油(保湿剂)、甜味剂和香精等,搅拌均匀后制得牙膏。
(1)牙膏是_____(填“纯净物”或“混合物”)。“佳洁士”独特的氟泰配方即氟化钠+二氧化硅,不仅能减少牙齿磨损,还帮助防止牙齿表面____;氟化钠中“氟”是指_____(填“分子”“原子”或“元素”),二氧化硅中硅元素的化合价为_______。
(2)测定自制牙膏及其他清洁用品的pH,记录如下:
物 质 | 自制牙膏 | 洁厕灵 | 油污净 |
pH | 8 | 2 | 12 |
自制牙膏显_____(填“酸性”“碱性”或“中性”),牙膏能使酚酞试液变成_______。
(3)牙膏中常常加入一些细微的粉末作为牙膏的摩擦剂,以增大摩擦力,提高洁齿的效果。下列提供三种不同类型牙膏中的摩擦剂,要求填写分别所属的物质类别和化学式:
牙膏品牌 | “两面针” 儿童牙膏 | “高露洁”氟钙牙膏 | “佳洁士” 茶爽牙膏 |
摩擦剂 | 氢氧化铝 | 碳酸钙 | 二氧化硅 |
摩擦剂的物质类别 (化合物分类) | ______ | ______ | ______ |
摩擦剂的化学式 | ______ | ______ | ______ |
根据你的生活经验推测,牙膏摩擦剂的溶解性是______(填“易溶”或“难溶”)性。由此你还可以选择廉价易得的牙膏摩擦剂,要求至少一种,写出化学式______。
【题目】中国“盐湖城”格尔木市举办世界钾盐钾肥大会,我国将成为世界第四大加盐钾肥生产国。下表是重要钾盐氯化钾在不同温度下的溶解度(单位:g/100g水)
温度/℃ | 20 | 40 | 60 | 80 |
KCl溶解度 | 34.0 | 40.0 | 45.5 | 51.1 |
某化学兴趣小组同学在20℃的l00g水中进行了如图所示的实验,请据图回答问题:

(1)从表中数据可以看出氯化钾的溶解度随温度升高而_____(填“增大”或“减小”);
(2)图中烧杯A中所得到的溶液属于_____(填“饱和”或“不饱和”)溶液,溶液质量为___g;
(3)图中烧杯B中的溶质质量分数为___________;
(4)图中烧杯C和D中的溶液相同的是 __________(填序号)
①溶质的质量 ②溶剂的质量 ③溶液的质量 ④溶质的质量分数