题目内容
【题目】文献资料表明,某些金属与酸反应存在氯离子效应,即氯离子的存在能加快其反应速率。
(1)某化学小组为了探究氯离子效应,在室温下,进行了如下实验。
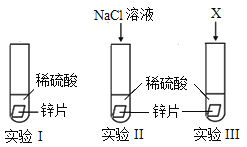
记录现象:实验II比实验I产生气泡快。
①实验I主要目的是_____,写出实验I中反应的化学方程式:_____。
②为了说明实验II中反应速率加快是氯离子效应,实验III中X是_____(填标号)。
a.Na2SO4溶液 b.Na2CO3溶液 c.NaOH溶液 d.H2O
③上述三个实验还应控制相同的条件是:_____(写两点)。
(2)为了进一步探究温度和氯离子对反应速率的影响,化学小组又在不同温度下进行了两组实验,数据如下表所示(表中“所用时间”是指锌与稀硫酸反应生成15mL氢气所用的时间)。
序号 | 温度环境(℃) | 未加入氯化钠所用时间(s) | 加入氯化钠所用时间(s) |
1 | 27 | 63 | 32 |
2 | 37 | 59 | 21 |
3 | 47 | 36 | 18 |
4 | 57 | 22 | 11 |
5 | 67 | 15 | 10 |
6 | 77 | t | 8 |
④表中数据可得出:温度升高,锌与稀硫酸的反应速率_____(填“变大”或“变小”)。
⑤表中t的数值范围是_____。
⑥由表中数据可知:温度升高,锌与稀硫酸反应的氯离子效应减弱,可能的原因是:_____。
【答案】对照实验 ![]() A 稀硫酸的浓度、锌片的大小、锌片形状 变大 t<15s 温度升高,氢离子运动速率加快
A 稀硫酸的浓度、锌片的大小、锌片形状 变大 t<15s 温度升高,氢离子运动速率加快
【解析】
(1)①该实验的目的是探究氯离子效应,实验Ⅰ中未加入氯化钠,实验Ⅱ中加入氯化钠,通过实验ⅠⅡ的对比来验证氯离子是否能加快反应速率,故实验Ⅰ的主要目的是:对照实验;
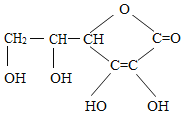
锌与稀硫酸反应生成硫酸锌和氢气,该反应的化学方程式为:![]() ;
;
②实验Ⅱ中加入的是氯化钠,无法确定是钠离子加快反应速率还是氯离子加快反应速率,故实验Ⅲ中加入的试剂应含有钠离子,验证不是钠离子加快反应速率,同时加入的试剂又不能与硫酸反应。
故选A;
③由控制变量法可知,该实验探究氯离子效应,故变量应为是否加入了氯离子,但是稀硫酸的浓度、锌片的大小、形状应相同,故填:稀硫酸的浓度、锌片的大小、锌片形状;
(2)④由图中数据可知,温度越高,锌与稀硫酸反应生成15mL氢气所用的时间越短,说明温度越高,锌与稀硫酸的反应速率变大;
⑤温度升高,反应速率变大,锌与稀硫酸反应生成15mL氢气所用的时间变短,故t<15s;
⑥由表中数据可知,温度越高,锌与稀硫酸反应生成15mL氢气所用的时间越短,说明温度越高,锌与稀硫酸反应速率越快,但是温度升高,锌与稀硫酸反应的氯离子效应减弱,可能是温度对反应速率的影响更大,温度升高,氢离子的运动速率加快,反应速率加快,氯离子效应从而减弱,故可能的原因是:温度升高,氢离子运动速率加快。