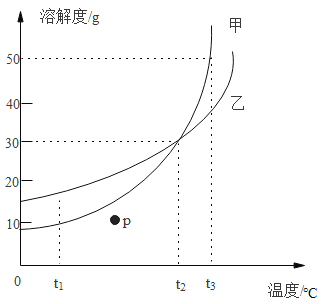
题目内容
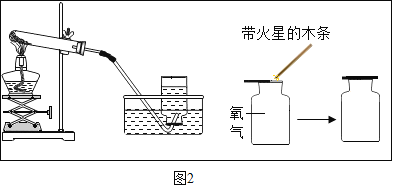
【题目】已知木炭粉(C)与某红棕色粉末(Fe2O3)在高温下反应生成二氧化碳(CO2)和铁(Fe)。某同学设计如下图装置测定红棕色粉末(Fe2O3)中氧元素的质量分数。
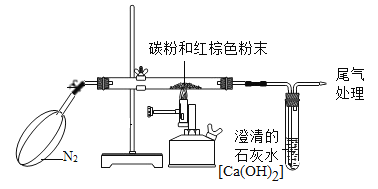
(1)实验前,要进行的操作是________________。
(2)实验开始时,要先通入纯净而干燥的N2,目的是________________。
(3)如果 3.2 g 该红棕色粉末与木炭粉充分反应,测得足量的澄清石灰水[Ca(OH)2]增重1.32g,反应生成的CO2中氧元素的质量是___________,该红棕色粉末中氧元素的质量分数为___________。
【答案】检查装置的气密性 将装置内的空气排尽 0.96g 30%
【解析】
(1)实验前,要进行的操作是:检查装置的气密性;
(2)空气中含有二氧化碳和氧气,可能会使生成物的质量增加,影响实验结果,故实验开始时,要先通入纯净而干燥的N2,目的是:将装置内的空气排尽;
(3)木炭粉(C)与某红棕色粉末(Fe2O3)在高温下反应生成二氧化碳(CO2)和铁(Fe),该反应的化学方程式为: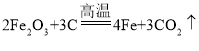 ,测得足量的澄清石灰水[Ca(OH)2]增重1.32g,说明生成二氧化碳的质量为1.32g,故反应生成的CO2中氧元素的质量是:
,测得足量的澄清石灰水[Ca(OH)2]增重1.32g,说明生成二氧化碳的质量为1.32g,故反应生成的CO2中氧元素的质量是:![]() ;
;
由化学方程式可知,三氧化二铁中的氧元素全部转化到了二氧化碳中,故该红棕色粉末中氧元素的质量分数为:![]() 。
。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案【题目】对比实验室实验探究的重要方法,下列对比实验设计能实现相应实验目的的是
选项 | A | B | C | D |
实验设计 |
|
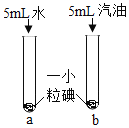
|
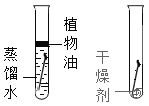
|
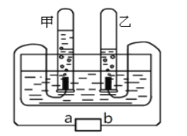
|
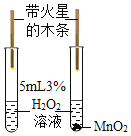
实验目的 | 探究CO2 与水发生了反应 | 探究水对铁钉锈蚀的影响 | 探究溶剂种类对物质溶解性的影响 | 探究MnO2是H2O2分解的催化剂 |
A.AB.BC.CD.D
【题目】在一个密闭容器中放入M、N、Q、P四种物质,在一定条件下充分反应后,测得有关数据如下表所示:
物质 | M | N | Q | P |
反应前质量/g | 4 | 10 | 1 | 21 |
反应后质量 /g | 0 | 12 | 15 | 待测 |
已知M的相对分子质量为n,P的相对分子质量为2n,下列推理正确的是 。
A.反应后生成Q的质量为15g
B.反应中N与P发生改变的质量之比为1∶1
C.反应后P的质量为12g
D.该反应化学方程式中M与P的化学计量数之比为2∶3