题目内容
【题目】某同学配制60g溶质质量分数为5%的NaCl溶液,准备了下列实验用品.回答下列问题:

(1)该同学按下列实验步骤进行:①计算,②称量,③量取,④________(填步骤名称).
(2)配制过程还缺少的一种玻璃仪器是__________(填名称).
(3)计算所需NaCl的质量___g,称量时,NaCl应放在托盘天平的__盘(填左、右)上.
(4)量取蒸馏水操作如下:将蒸馏水注入量筒,待液面接近量取体积对应刻度线时,改用_______(填仪器名称)滴加蒸馏水至刻度线.
(5)若用俯视的方式量取水的体积,所配制溶液的溶质质量分数会______(填“偏大”、“偏小”或“无影响”).
【答案】 溶解 玻璃棒 3 左 胶头滴管 偏大
【解析】(1)配制溶液的步骤是:①计算,②称量,③量取,④溶解;
(2)配制过程需要的玻璃仪器是烧杯、量筒、玻璃棒、胶头滴管,还缺少玻璃棒;
(3)配制60g溶质质量分数为5%的NaCl溶液,需NaCl的质量为60g×5%=3g;天平称量物体的原理是左物右码,NaCl应放在托盘天平的左盘;
(4)量取蒸馏水时,将蒸馏水注入量筒,待液面接近量取体积对应刻度线时,改用胶头滴管滴加蒸馏水至刻度线;读数时视线应与凹液面的最低处保持水平;
(5)俯视时读数偏大,实际量取的水体积偏少,会造成配制溶液的溶质的质量分数会偏大。

【题目】如表为氯化钠和硝酸钾的溶解度:
10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 70℃ | 80℃ | |
NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 |
KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 |
(1)60℃时,KNO3的溶解度为_____;表中“37.8”的意义是 _____。
(2)20℃时KNO3 的溶解度_____(选填“大于”“小 于”)NaCl的溶解度。随着温度升高,NaCl的溶解度 _____(选填“变大”“变小”或“不变”)。
(3)20℃时,完全溶解18 g NaCl 恰好得到饱和溶液,所需水的质量是 _____g,该溶液质量分数为 _____。
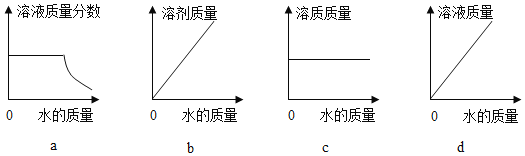
(4)20℃时,向 10 g KNO3 固体不断加水,有关图像正确的是_____(选填编号)。