题目内容
(12分)甲、乙、丙、丁四种物质在一定条件下能发生如下反应:
甲+乙 丙+丁
丙+丁
(1)若甲、丙为化合物,乙、丁为单质,则上述反应的基本反应类型是 ,写出一个符合该反应类型的方程式: 。
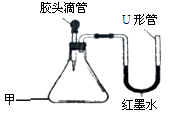
(2)若甲、乙、丙、丁均为化合物,且甲溶液呈蓝色,乙为烧碱,则乙的化学式为
,反应发生时观察到的现象是 。
(3)若甲、乙、丙、丁均为化合物,且丙为水,丁为盐,则该反应 (“一定”或“不一定”)是中和反应,理由是 。
(4)若甲、乙、丙为化合物,丁为单质,且乙、丙是组成元素相同的气体,该反应在工业上的用途是 。
(1)置换 C+ 2CuO 高温2Cu + CO2↑ (2) NaOH 产生蓝色沉淀
(3) 不一定 中和反应是指酸碱发生反应,而甲、乙不一定是酸、碱
(4)冶炼金属
解析试题分析:(1)置换反应概念:由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应,故若甲、丙为化合物,乙、丁为单质,则反应的基本反应类型是置换,符合该反应类型的方程式:C+ 2CuO 高温2Cu + CO2↑或H2 + CuO △ Cu + H2O
(2)烧碱是氢氧化钠的俗名,化学式为NaOH,因为甲溶液呈蓝色,说明含铜离子,故反应发生时观察到的现象是:产生蓝色沉淀
(3)中和反应是指酸碱作用生成盐和水的反应,虽然生成物丙为水,丁为盐,但反应物并不能确定是酸碱,如反应:2NaOH + CO2 ="=" Na2CO3 + H2O,生成盐和水,但不是复分解反应
(4)若甲、乙、丙为化合物,丁为单质,且乙、丙是组成元素相同的气体,则可推断乙应为CO,丙为CO2,体现了一氧化碳的还原性,在工业上的用途是冶炼金属
考点:化学反应基本类型,中和反应,一氧化碳的还原性,化学反应的现象

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案铬(Cr)是一种重要的金属材料,它具有良好的金属光泽和抗腐蚀性,常用来镀在其他金属的表面上,铜、铬、锰、镍组成合金可以制成各种性能的不锈钢。某校化学研究小组对Cr(铬)、Al、Cu的金属的活动性顺序进行探究,过程如下:
(1)[作出假设]对三种金属的活动性顺序提出三种可能的假设是:
①Cr>Al>Cu②Al>Cr>Cu③Cr>Cu>Al
[设计实验]同温下,取大小相同的这三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,观察现象,记录以下:
| 金属 | Cr | Al | Cu |
| 与盐酸反应现 | 气泡产生缓慢,金属逐渐溶解 | 气泡产生激烈,金属迅速溶解 | 无气泡产生,金属无变化 |
[控制实验条件]三种金属加入盐酸前都先用纱布将其表面擦光亮,其目的是 。
A.除去氧化膜,利于直接反应
B.使表面光亮,易观察现象
C.使金属温度相同,易反应
[得出结论]原假设中正确的是 (选填假设中①、②,③)。写出铬(铬与盐酸反应后显+2价)与盐酸反应的化学方程式 。
[结论应用]根据探究结果,请你预测铬与硫酸铜溶液 (填“能”或“不能”)反应,理由是 。
(12分)碱式碳酸盐广泛应用于工农业生产。
(1)某碱式碳酸盐样品M(OH)2·MCO3,为确定金属M的相对原子质量,某研究小组设计如下实验装置及步骤(不考虑植物油中溶解CO2产生的影响)。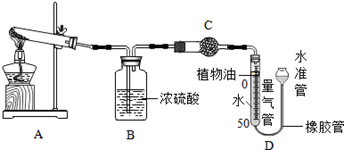
①连接装置并 ;②准确称量样品的质量;③装药品,调节量气装置两边液面相平,读数;④加热至样品质量不再减少;⑤冷却到室温;⑥调节量气装置两边液面相平,读数、列式计算。
Ⅰ.请将上述实验步骤补充完整;
Ⅱ.装置B的作用是 ,少量植物油的作用是 ,C中的试剂是 (填字母序号);
a.碱石灰 b.浓硫酸 c.硫酸铜
Ⅲ.步骤⑥中调节液面相平的操作是将水准管 (填“缓慢上移”或“缓慢下移”)。
Ⅳ.若其他操作均正确,仅因下列因素可使M相对原子质量的测定结果偏大的是 (填字母序号);
a.反应前量气管水面在0刻度处,反应后仰视读数
b.样品未分解完全即停止实验
c.量气管中未加植物油
(2)实际生产中的碱式碳酸铜可表示为Cu(OH)2·mCuCO3,某研究小组仍使用上述装置测定m的值,测得3组数据如下表所示。取3组数据的值得到CO2的体积为 mL,又知常温常压下CO2的密度为1.964 g/L,据此计算m的值。(写出计算m的过程,最后结果保留小数点后两位) 。
| 组别 | 样品质量 | CO2体积 |
| 第1组 | 0.21 g | 22.39 mL |
| 第2组 | 0.21 g | 22.41 mL |
| 第3组 | 0.21 g | 22.40 mL |