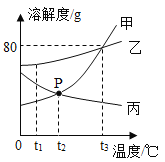
题目内容
【题目】某化学小组的同学判断稀硫酸和氯化铁溶液不能发生复分解反应。为了进一步确认该判断的可靠性,该小组同学将一定量稀硫酸和一定量氯化铁溶液在烧杯中混合后,进行了如下探究活动。
(1)甲同学取烧杯中混合溶液进行实验,成功地检验出混合液中含有H+和SO42-,于是得出结论------稀硫酸与氯化铁溶液没有发生反应。
①乙同学认为甲同学的结论不正确,原因是__________。
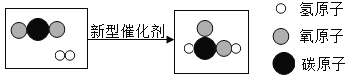
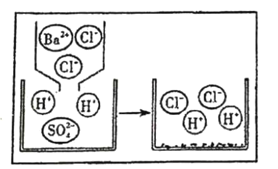
②如图为H2SO4与BaCl2发生反应的微观粒子反应示意图(在水溶液中进行反应,水分子已省略),请从微观角度分析该反应的实质_______。
(2)为了进一步确认两者没发生反应,还需检验烧杯内的混合液中是否含有氯化铁。于是,乙同学设计了如下两个实验:
①取少量烧杯内的混合液于试管中,逐滴加入过量的________溶液,证明了混合液中含有Fe3+。整个实验过程中乙同学观察到的实验现象是__________。
②另取少量烧杯内的混合液,通过实验成功地检验出混合液中含有Cl-。他设计的方案为_______(写出操作和现象)。
[总结]通过上述实验,该小组同学证明了稀硫酸和氯化铁溶液确实没有发生反应。
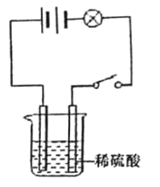
[学科渗透]如图所示,该小组在进行溶液导电性的实验时,将电极两端插入稀硫酸溶液中,闭合开关,小灯泡正常发光,然后逐滴向稀硫酸中加入稀Ba(OH)2溶液至过量。请写出该反应的化学方程式___________;推测小灯泡的发光情况为_________。
【答案】可能稀硫酸过量 硫酸根离子和钡离子形成硫酸钡沉淀 氢氧化钠溶液 刚开始溶液无现象,一段时间后产生红褐沉淀,溶液由黄色变为无色 先往烧杯中滴加入过量的硝酸钡溶液,有白色沉淀产生,过滤,再向滤液加入适量的硝酸银溶液和稀硝酸,有不溶于稀硝酸的白色沉淀产生 ![]() 先变亮再变暗最后变亮
先变亮再变暗最后变亮
【解析】
(1)①从混合液中检验出含有H+和SO42-,得出稀硫酸与氯化铁溶液没有发生反应的结论。该结论不正确,原因是可能稀硫酸过量,溶液中也含有H+和SO42-。
②根据H2SO4与BaCl2发生反应的微观粒子反应示意图分析,反应前后溶液中都含有氯离子和氢离子,而反应后溶液中没有硫酸根离子和钡离子,所以该反应的实质是硫酸根离子和钡离子形成硫酸钡沉淀。
(2)①混合液中含有硫酸和氯化铁,逐滴加入过量的氢氧化钠溶液,氢氧化钠先与硫酸反应,排除干扰,如果有红褐色沉淀产生,溶液由黄色变为无色,证明了混合液中含有Fe3+。
②另取少量烧杯内的混合液,先往烧杯中滴加入过量的硝酸钡溶液,有白色沉淀产生,过滤,目的是先把硫酸除去,防止干扰氯离子的检验;再向滤液加入适量的硝酸银溶液和稀硝酸,有不溶于稀硝酸的白色沉淀产生,证明有溶液中含有氯离子。
(3)向稀硫酸中加入稀Ba(OH)2溶液至过量。该反应的化学方程式为![]() ;小灯泡的发光情况是:刚插入稀硫酸溶液中,溶液中含有氢离子和硫酸根离子,溶液能导电,灯泡发亮;当硫酸与氢氧化钡发生反应时,溶液中的离子减少,灯泡变暗;当加入过量的氢氧化钡溶液时,溶液中含有氢氧根离子和钡离子,溶液能导电,灯泡变亮。
;小灯泡的发光情况是:刚插入稀硫酸溶液中,溶液中含有氢离子和硫酸根离子,溶液能导电,灯泡发亮;当硫酸与氢氧化钡发生反应时,溶液中的离子减少,灯泡变暗;当加入过量的氢氧化钡溶液时,溶液中含有氢氧根离子和钡离子,溶液能导电,灯泡变亮。

【题目】“504双吸剂”的成分如标签所示,甲、乙两位同学对一包久置的“504双吸剂”探究,他们猜想久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2、CaCO3。

已知:铁与氧化铁溶液反应的化学方程式为:Fe+2FeCl3═3FeCl2。
请你补充甲同学设计并记录的部分实验报告:
实验操作 | 实验现象 | 实验结论 |
1.取少量固体于试管中,_______,将生成气体通入澄清石灰水中。 | 产生大量气泡,得到浅绿色溶液,澄清石灰水变浑浊。 | 固体中一定含有_____,不一定含Fe2O3 |
2.取少量固体于试管中,加水溶解,静置后取上层清液滴加无色酚酞试液。 | 试管底部有不溶物,试管外发热,____ | 固体中含有CaO和Ca(OH)2 |
写出实验操作1中产生大量气泡的反应的化学方程式__________________。
(若正确回答下列问题加4分,总分不超过40分)
实验质疑:乙同学认为“固体中含有CaO和Ca(OH)2”的实验结论不正确,请阐述理由___________。
请你设计实验探究固体中是否含有Fe2O3______________(写出实验步骤即可)。
【题目】在密闭容器内有氧气、二氧化碳、水蒸气和一种未知物质W,在一定条件下充分反应,测得反应前后各物质的质量如表所示,则下列说法中正确的是( )
物质 | 氧气 | 二氧化碳 | 水蒸气 | W |
反应前质量/g | 50 | 1 | 1 | 23 |
反应后质量/g | 2 | 45 | 28 | x |
A. 根据质量守恒定律,x的值应为2
B. 该反应属于置换反应
C. 该反应中的二氧化碳和水蒸气的质量比为44:27
D. 该反应中物质W含碳元素的质量为10g