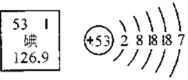
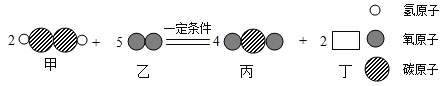
题目内容
【题目】在密闭容器内有氧气、二氧化碳、水蒸气和一种未知物质W,在一定条件下充分反应,测得反应前后各物质的质量如表所示,则下列说法中正确的是( )
物质 | 氧气 | 二氧化碳 | 水蒸气 | W |
反应前质量/g | 50 | 1 | 1 | 23 |
反应后质量/g | 2 | 45 | 28 | x |
A. 根据质量守恒定律,x的值应为2
B. 该反应属于置换反应
C. 该反应中的二氧化碳和水蒸气的质量比为44:27
D. 该反应中物质W含碳元素的质量为10g
【答案】C
【解析】
A、由表中数据分析可知,反应前后,氧气的质量减少了50g-2g=48g,所以氧气是反应物,参加反应的氧气的质量为48g;同理可以确定二氧化碳是生成物,生成的二氧化碳的质量为45g-1g=44g;水蒸气是生成物,生成的水蒸气的质量为28g-1g=27g;由质量守恒定律,W应是反应物,且参加反应的W的质量=27g+44g-48g=23g,所以x的数值为23g-23g=0g,故A错误;
B、该反应中W和氧气减少是反应物,二氧化碳和水蒸气增多是生成物,该反应中生成物是两种化合物,不属于置换反应,故B错误;
C、该反应中的生成的二氧化碳和水蒸气的质量比=44:27,故C正确;
D、依据质量守恒定律可知,该反应中物质W含碳元素的质量等于二氧化碳中碳元素的质量=![]() ,故D错误。故选C。
,故D错误。故选C。

【题目】KCl与KNO3在不同温度的溶解度数据如表.则下列说法正确的是( )
温度/℃ | 10 | 20 | 30 | 40 | 50 |
KCl | 30g | 33g | 35g | 38g | 41g |
KNO3 | 21g | 31g | 45g | 65g | 88g |
A.KNO3比KCl的溶解度大
B.两物质的溶解度相等的温度在20~30℃之间
C.在20℃时,10g水中加入5g KCl可得到33.3%的KCl溶液
D.在50℃时,两物质各5g分别加入10g水中,充分溶解,均有固体剩余
【题目】气在生产、生活中有广泛用途,研究其制取、性质和用途十分重要.
(1)工业上用氮气和氢气在高温高压和催化剂存在时合成氨;实验室用氯化铵和熟石灰在加热条件下制取氨气,同时生成氯化钙和水.请分别写出有关反应的化学方程式___________.实验室制取氨气的发生装置与制取哪种气体的相似,请写出实验室制取该气体的化学方程式:__________
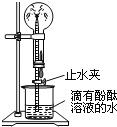
(2)如图是氨气性质的趣味实验:圆底烧瓶中充满氨气,当挤压胶头滴管并打开止水夹时,烧杯中的水迅速进入烧瓶,形成美丽的“喷泉”,进入烧瓶的水变成红色.由该实验可得出哪些结论___________
(3)氨气常作制冷剂及化肥,同时,它还可作清洁能源.已知表信息:
性质 | 颜色、气味 | 沸点(℃) | 25℃水中溶解度(g/L-1) |
NH3 | 无色、刺激性 | -33 | 456 |
H2 | 无色、无味 | -253 | 0.0015 |
一定条件下氨气在纯氧中完全燃烧生成水和氮气,写出该反应的化学方程式______________________.
液氨有望和液氢一样成为新一代绿色能源.与H2相比,用NH3作燃料的优点之一是便于储存和运输;优点之二是泄漏时易发现且便于处理.请对氨气的优点加以解释说明_________________