题目内容
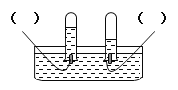
【题目】为测定锌铜合金中锌的含量,取该合金放入如右图盛有稀硫酸的锥形瓶中 。多次实验后,取平均值所得数据如下表:
反应前 | 充分反应后装置及反应剩余物质质量 | |
装置和足量的稀硫酸质量 | 锌铜合金质量 | |
342.10g | 16.00g | 357.70g |

若不考虑干燥剂吸收空气中的水蒸气,计算:
(1)根据质量守恒定律求生成氢气的质量 。
(2)该合金中锌的质量分数。
【答案】(1)0.4克(2)81.25%
【解析】
试题分析:依题意可得氢气的质量=342.10g+16.00g-357.70g =0.4g
解:设该合金中锌的质量为x。
Zn + H2SO4=ZnSO4+H2↑
65 2
x 0.4g
列比例式得:65︰2= x︰0.4g 解得: x=13 g
合金中锌的质量分数=13 g÷16 g×100%=81.25%

 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案【题目】下图为甲、乙两种物质的溶解度曲线。
资料:常温(20 ℃)下,溶解度的相对大小。
溶解度/g | <0.01 | 0.01~1 | 1~10 | >10 |
一般称为 | 难溶 | 微溶 | 可溶 | 易溶 |
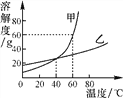
(1)常温下,乙属于________(填“易溶”“可溶”“难溶”或“微溶”)物质。
(2)________ ℃时,甲、乙两种物质的溶解度相等。
(3)60 ℃时,甲饱和溶液中溶质的质量分数为________。
(4)把60 ℃时质量相等的甲、乙饱和溶液降温到20 ℃,析出晶体较多的物质是________。
(5)要使乙的饱和溶液中溶质大量结晶析出,应该采用________的方法。
(6)若要从甲、乙的混合溶液中提纯甲,则主要操作是蒸发浓缩、________、________、干燥。
【题目】氧气是一种比较活泼的气体,许多物质都能与氧气发生反应。下列物质在足量氧气中燃烧的产物正确的是
选项 | A | B | C | D |
物质 | Fe(铁丝) | S(硫粉) | C(木炭) | H2(氢气) |
在足量氧气中燃烧的产物 | 氧化铁 (Fe2O3) | 二氧化硫 (SO2) | 一氧化碳 (CO) | 过氧化氢 (H2O2) |
A. A B. B C. C D. D