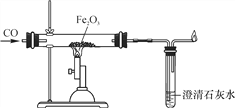
题目内容
【题目】化工生产中需要对原料提纯,以利于提高产品质量。经测定某氯化钠样品中混有硫酸钠,为了除杂质并制得纯净的氯化钠固体,在实验室研究中某学生设计方案如下:
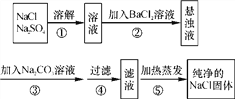
回答下列问题。
(1)操作②能否用硝酸钡溶液?说明理由。________________________________________。
(2)进行操作②后,如何判断硫酸钠已除尽,方法是_____________________________________________________。
(3)操作③的目的是________________,③、④的操作顺序能否交换,其理由是________________。
(4)此设计方案是否严密,说明理由__________________________________________________________。
【答案】 不能,用硝酸钡溶液会引入新的杂质硝酸钠 取少量上层清液于小试管中,滴加氯化钡溶液,观察是否有沉淀生成,若无沉淀生成,则说明硫酸钠已除尽 使钡离子完全沉淀 不能,得不到滤液 不严密,会使得滤液中混有碳酸钠,加热蒸发得到的NaCl固体不纯
【解析】(1). 不能用硝酸钡,因硝酸钡溶液和硫酸钠反应生成硫酸钡沉淀和硝酸钠而引入新的杂质; (2). 利用硫酸钠与氯化钡生成白色沉淀,取少量上层清液于小试管中,滴加氯化钡溶液,观察是否有沉淀生成,若无沉淀生成,则说明硫酸钠已除尽,反之则没有除尽; (3). 除硫酸钠时加入了过量的氯化钡,如果不除掉会引入杂质,所以加入碳酸钠,利用碳酸钠和氯化钡生成碳酸钡沉淀和氯化钠,而使钡离子完全沉淀; (4). ③、④的操作顺序能否交换,碳酸钡无法除掉,得不到滤液; (5). 此设计方案不严密,会使得滤液中混有碳酸钠,加热蒸发得到的NaCl固体不纯,应在蒸发结晶前再向溶液中加入足量的盐酸,将过量的碳酸钠除掉。

【题目】为测定锌铜合金中锌的含量,取该合金放入如右图盛有稀硫酸的锥形瓶中 。多次实验后,取平均值所得数据如下表:
反应前 | 充分反应后装置及反应剩余物质质量 | |
装置和足量的稀硫酸质量 | 锌铜合金质量 | |
342.10g | 16.00g | 357.70g |

若不考虑干燥剂吸收空气中的水蒸气,计算:
(1)根据质量守恒定律求生成氢气的质量 。
(2)该合金中锌的质量分数。