题目内容
【题目】我国化学家侯德榜创立的侯氏制碱法为纯碱工业技术的发展做出了杰出的贡献。
在制备纯碱的过程中涉及NaCl、NH4Cl、NaHCO3等物质。请结合表格数据回答下列问题:
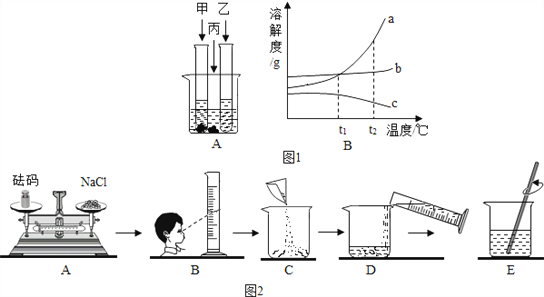
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
NaHCO3 | 6.9 | 8.2 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | |
(1)表中物质中,溶解性属于可溶的物质是_____。
(2)在40℃时,向100g水中加入50gNH4Cl,充分搅拌所得溶液质量为_____g:保持烧杯中各物质质量不变,升温至50℃时,所得溶液溶质的质量分数是_____。
(3)要使20℃时接近饱和的 NaHCO3溶液变成该温度下的饱和溶液,可采用的一种方法是_____。
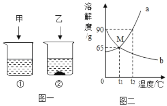
(4)有一杯60℃的NH4Cl的不饱和溶液(如图A,水为100g),经过如图的变化过程(在整个过程中水分的蒸发忽略不计),请判断:
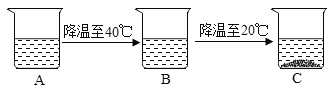
①有关三个烧杯中溶液的下列说法中,正确的是_____(填字母序号)。
a.在变化过程中,溶解度一定发生改变
b.B烧杯中的溶液一定是不饱和溶液
c.由40℃降温至30℃时溶液质量有可能减少
d.A到B的变化过程中,溶液中溶质的质量分数没有发生改变
②A烧杯中溶解的溶质的质量m的范围是_____。
【答案】NaHCO3 145.8 33.3% 加 NaHC03 (或恒温蒸发水分) a、c、d 37.2g<m<45.8g
【解析】
(1)20℃时,溶解度大于1g小于10g的物质属于可溶物质,所以表中二种物质中,溶解性属于可溶的物质是碳酸氢钠;
(2)40℃时,氯化铵的溶解度为45.8g,所以在该温度下,向100g水中加入50gNH4Cl,充分搅拌氯化铵不能完全溶解,所得溶液质量为45.8g+100g=145.8g;保持烧杯中各物质质量不变,升温至50℃时,氯化铵完全溶解,此时所得溶液溶质的质量分数是![]() ×100%≈33.3%;
×100%≈33.3%;
(3)要使20℃时接近饱和的 NaHCO3溶液变成该温度下的饱和溶液,可采用加入碳酸氢钠或蒸发水的方法;
(4)①a、在变化过程中,温度发生了改变,所以溶解度一定发生改变,正确;
b、B烧杯中的溶液可能是饱和溶液,也可能是不饱和溶液,错误;
c、由40℃降温至30℃时溶液质量有可能析出晶体,若析出晶体则溶液质量会减少,若没有晶体析出,溶液质量就不会减少,错误;
d.A到B的变化过程中没有晶体析出,所以溶液中溶质的质量分数没有发生改变,正确;
②A杯为60℃的NH4Cl的不饱和溶液,且降温到40摄氏度时无晶体析出,即其中溶质的质量小于45.8g,降温至20℃时析出部分晶体,则其中溶质的质量大于37.2g。

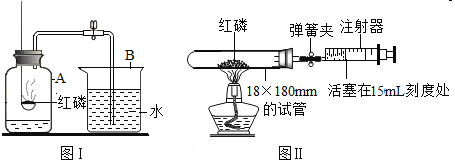
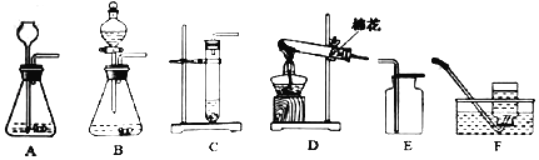
【题目】木炭作为还原剂用于金属冶炼已有几千年历史。教材用如图Ⅰ实验介绍这一知识。
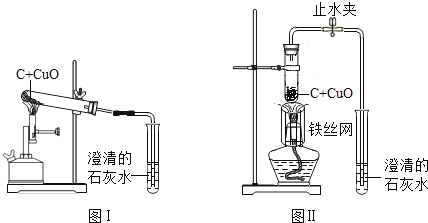
(1).木炭与氧化铜反应的化学方程式是______。
(2).酒精灯火焰处加有铁丝网罩,其作用是______。
(3).固定试管时,试管口要略向下倾斜,其目的是______。
(4).图Ⅰ与教材中的装置还是略作了改进,实验结束时,可先用弹簧夹夹紧橡皮管,再熄灭酒精灯,这样做的目的除了防止石灰水倒吸入热的试管,使试管炸裂外,还可以防止______。
(5).为了提高成功率,某研究小组设计如图Ⅱ方案进行实验。
(实验研究)
分别称取2g木炭与![]() 混合物,按每种比例重复实验3次。实验记录如下表:
混合物,按每种比例重复实验3次。实验记录如下表:
总质量相同(2g)但木炭与![]() 比例不同的实验对比表
比例不同的实验对比表
比例 | 1:6 | 1:7 | 1:8 | 1:9 | 1:10~1:11 | 1:12 | 1:13 |
加热时间 |
|
|
|
|
|
|
|
实验现象 | 红热,产生大量气泡,石灰水变浑浊 | 偶尔红热,气泡较少 | |||||
实验结果 | 表层铜球较大,出现未完全反应的黑色木炭粉末,且木炭含量越高黑色粉末越多 | 反应较完全,生成亮红色网状铜块 | 部分生成 | 主要产物是 | |||
由实验数据分析,除温度外,影响实验的因素是______;
从产物分析,该反应混合物的最佳比例范围是______。
(装置改进)
稳定的高温是本实验成功的关键因素之一,实验装置也会影响加热的效率。图Ⅱ装置将卧式装置改为直立式装置。实验时,将反应混合物夯实于试管底部,调节酒精灯使外焰完全包围试管的下部。你认为该设计是否更好?______(填“是”或“否”);理由是______。
(交流讨论)
由于试管中有空气,实验时应注意:
①混合物需进行预热,除了使试管受热均匀外,另外的目的是______。
②从理论上讲,并不能把石灰水变浑浊作为木炭跟![]() 开始反应的充分证据。其理由是______。
开始反应的充分证据。其理由是______。
【题目】青少年看书、写字一定要爱护眼晴,台灯是在光线不足时常用的照明用具。
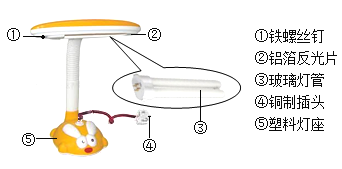
(1)图中序号标示的材料一共分为_____类。
(2)灯管后面的反光片为铝箱。铝块能制成铝箔是利用了铝的_____性
(3)铝比铁活泼,但铝箔比铁螺丝钉耐腐蚀。铝制品耐腐蚀的原因是_____(用方程式表示)
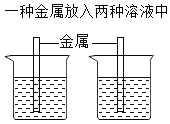
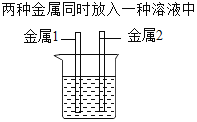
(4)为验证铁、铜、铝的活动性顺序,甲乙两位同学设计了不同的实验方案,都达到了实验目的。所用的试剂有铝片、铁片、铜片、硫酸铝溶液、硫酸亚铁溶液、硫酸铜溶液。实验方案如下:
实验方案 | 方案一 | 方案二 |
实验操作 |
|
|
①方案一中有关反应的化学方程式是_____;
②方案二中选择的溶液是_____(写化学式)溶液;
③军军同学又设计了一个新的方案,也能达到实验目的。将三种金属分别放入一种溶液中,该溶液中的溶质在物质分类上和前两位同学所用的试剂不同,他选择的溶液是_____。