题目内容
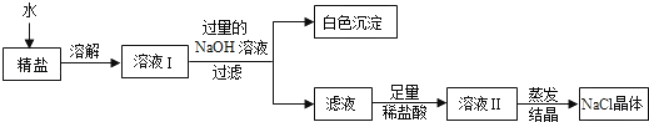
【题目】现有HCl与BaCl2的混合溶液,为了分析混合溶液中HCl和BaCl2的质量分数,设计了如下实验方案(假设反应都是充分完全):
(实验数据)实验共记录了两组数据:第①组,气体吸收完全后,NaOH溶液质量增加4.4g;第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为19.7g。根据实验设计及有关数据进行分析与计算:(结果均保留0.1%)
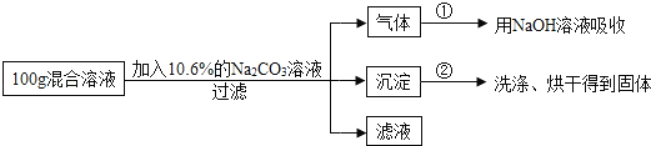
(1)混合溶液中BaCl2的质量分数为多少?
(2)若实验中混合溶液与Na2CO3溶液恰好完全反应,经过滤后所得滤液的质量为多少?
【答案】20.8%;275.9g
【解析】
解:(1)设氯化钡质量为x,和氯化钡反应的碳酸钠质量为y,NaOH溶液质量增加4.4g,说明碳酸钠和稀盐酸反应生成二氧化碳质量是4.4g,烘干后得到固体的质量为19.7g,说明碳酸钠和氯化钡反应生成碳酸钡质量是19.7g,
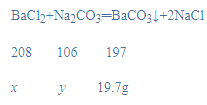
![]() x=20.8g,
x=20.8g,
![]() y=10.6g,
y=10.6g,
混合溶液中BaCl2的质量分数为:![]() ×100%=20.8%,
×100%=20.8%,
答:混合溶液中BaCl2的质量分数为20.8%;
(2)设与稀盐酸反应的碳酸钠质量为z,
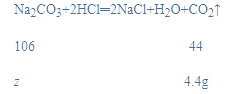
![]()
z=10.6g,
恰好完全反应时碳酸钠溶液质量为:![]() =200g,
=200g,
经过滤后所得滤液的质量为:100g+200g-19.7g-4.4g=275.9g,
答:经过滤后所得滤液的质量为275.9g。

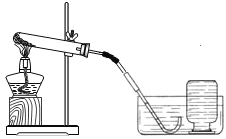
【题目】小明参观某养鱼池时,好奇的发现农民向养鱼池中撒一种淡黄色固体——过氧化钙,用来增加鱼池中的含氧量。
小明刚学完氧气的实验室制法,于是他想可否用过氧化钙制取氧气。
(提出问题)过氧化钙可否用于制取氧气?
(查阅资料)部分内容如下:过氧化钙(CaO2)室温下稳定,在300℃时分解生成氧气,主要用途可做增氧剂、杀菌剂等。
(猜想与验证)
(1)小明依据资料显示:加热过氧化钙可制取氧气。
实验装置 | 实验主要过程 |
| ①检查装置气密性。操作如下:先将导管伸入液面下,用手紧握试管,观察到________,松开手后,导管口有液面上升。 |
实验结论:加热过氧化钙可制取氧气。
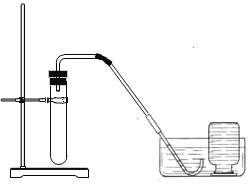
(2)小明联想到农民用过氧化钙增加鱼池中的含氧量,提出猜想Ⅱ.
猜想Ⅱ:过氧化钙与水反应可制取氧气。
实验装置 | 实验主要过程 |
| ①检查装置气密性。 |
实验结论:不能用过氧化钙与水反应制取氧气。
分析与反思:
虽然没有快速收集到大量氧气,但由此实验现象,小明推导出农民用过氧化钙做增氧剂的主要原因是 。
(3)小明希望对此实验进行改进,使该反应加快,你能帮他提出建议吗?
你的合理建议: 。
这些建议是否可行,还需进一步通过实验验证。
【题目】我国化学家侯德榜创立的侯氏制碱法为纯碱工业技术的发展做出了杰出的贡献。
在制备纯碱的过程中涉及NaCl、NH4Cl、NaHCO3等物质。请结合表格数据回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
NaHCO3 | 6.9 | 8.2 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | |
(1)表中物质中,溶解性属于可溶的物质是_____。
(2)在40℃时,向100g水中加入50gNH4Cl,充分搅拌所得溶液质量为_____g:保持烧杯中各物质质量不变,升温至50℃时,所得溶液溶质的质量分数是_____。
(3)要使20℃时接近饱和的 NaHCO3溶液变成该温度下的饱和溶液,可采用的一种方法是_____。
(4)有一杯60℃的NH4Cl的不饱和溶液(如图A,水为100g),经过如图的变化过程(在整个过程中水分的蒸发忽略不计),请判断:
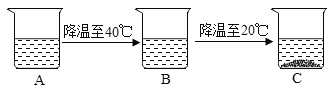
①有关三个烧杯中溶液的下列说法中,正确的是_____(填字母序号)。
a.在变化过程中,溶解度一定发生改变
b.B烧杯中的溶液一定是不饱和溶液
c.由40℃降温至30℃时溶液质量有可能减少
d.A到B的变化过程中,溶液中溶质的质量分数没有发生改变
②A烧杯中溶解的溶质的质量m的范围是_____。
【题目】化学反应之间、化学物质之间、微粒之间具有包含、并列、交叉等关系。下表中X、Y符合如图所示关系的是( )
A | B | C | D | |
X | 单质 | 化合反应 | 纯净物 | 化合反应 |
Y | 化合物 | 分解反应 | 混合物 | 氧化反应 |
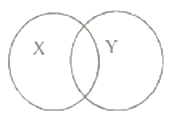
A. AB. BC. CD. D