题目内容
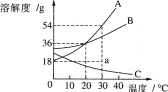
【题目】如图1所示,在室温下,甲、乙、丙三种固体分别溶于两支试管和一个烧杯的水中,现象图A所示,甲、丙还有剩余固体,乙固体全部溶解.升温到80℃时,发现甲固体全部溶解,乙固体析出,丙固体没有明显变化.
(1)室温时, ______ (选填“甲”、“乙”或“丙”)溶液可能是不饱和溶液.
(2)图1中B图中能表示乙物质的溶解度曲线的是 ______ (填“a”、“b”或“c”,下同);
(3)t2℃时,甲、乙、丙三种物质的等质量的饱和溶液中水的质量由大到小的顺序是 ______ .
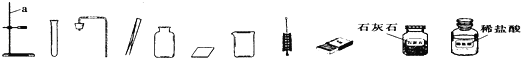
(4)小强同学要在实验室配制15%的氯化钠溶液50g.需要氯化钠的质量为______克,该同学按图2所示步骤依次操作:
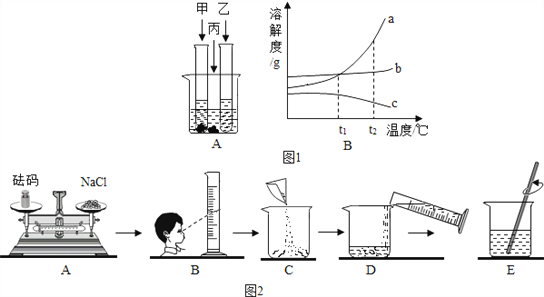
其中操作错误的步骤是 ______ (填字母);E中玻璃棒的作用是 ______.若上图A中砝码的质量为5g,游码为2.5g,则小明称得的氯化钠质量实际为 _____克.
【答案】 乙 c 乙、丙、甲 7.5 AB 加速溶解 2.5
【解析】(1)甲、丙溶液中有未溶解的固体而乙溶液中没有未溶解的固体,所以室温时,乙溶液可能是不饱和溶液;
(2)根据升温到80℃时,发现乙固体析出,所以乙物质的溶解度随温度的升高而减小,图2中能表示乙物质的溶解度曲线的是c;
(3)由曲线图可看出三物质中a、b两物质的溶解度都随温度升高而增大,而a受温度影响较大,c物质的溶解度随温度升高而减小,所以由题意知,a曲线表示甲物质溶解度曲线,b曲线表示丙物质的溶解度曲线,c曲线表示乙物质的溶解度曲线,t2℃时,甲、乙、丙三种物质的等质量的饱和溶液中,溶解度大的含水的质量小,溶解度小的,含水的质量大,所以t2℃时,甲、乙、丙三种物质的等质量的饱和溶液中,水的质量由大到小的顺序是乙、丙、甲;
(4)配制15%的氯化钠溶液50g,需要氯化钠的质量为:50g×15%=7.5g;使用托盘天平时应左物右码,量筒读数时应使视线与凹液面的最低处保持水平,在此实验中玻璃棒的作用为搅拌,其目的为加速溶解;小明称得的氯化钠质量实际为:5g-2.5g=2.5g。

 名校课堂系列答案
名校课堂系列答案【题目】下表是氯化铵在不同温度时的溶解度
温度/℃ | 20 | 40 | 60 | 80 |
溶解度/g | 40 | 50 | 58 | 68 |
据此数据,判断下列说法正确的是( )
A. 20℃时,氯化铵饱和溶液中氯化铵的质量分数是25%
B. 20℃时,70g氯化铵的饱和溶液升温至40℃得到不饱和溶液
C. 40℃时,75g氯化铵的饱和溶液中加入25g水后氯化铵的质量分数为30%
D. 80℃时,84g的氯化铵饱和溶液降温至60℃时有10g氯化铵析出