题目内容
【题目】(6分)称取一定质量的铜,放入足量稀硝酸中,反应的化学方程式:3Cu+8HNO3(稀)=3Cu(NO3)2+2R↑+4H2O(R表示产生气体的化学式)。用排水法收集产生的气体R,生成气体R的质量与反应时间的关系如图所示。
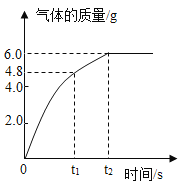
请回答下列问题:
(1)气体R的化学式是 。t1时,已反应的铜占铜的总质量的质量分数是 。
(2)称取铜的质量是多少?
【答案】(1)NO;80% (2)19.2g
【解析】
试题分析:根据质量守恒定律化学反应前后原子的种类和数目不变,反应前Cu:3,H:8,N:8,O:24,反应后Cu:3,H:8,N:6,O:22,R前有化学计量数2,故R的化学式为NO ;
利用化学方程式,根据反应的质量比即可计算出参加反应的铜的质量;
设t1时参加反应的铜的质量为x,
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
192 60
X 4.8g
192/60 =x/4.8g
X=15.36g
设称取的铜的质量为y,
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
192 60
Y 6g
192/60 =y/6g
y=19.2g
t1时,已反应的铜占铜的总质量的质量分数=15.36g/19.2g ×100% =80%
答:略

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目