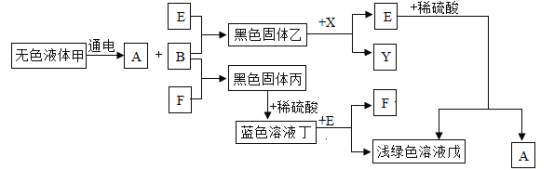
题目内容
【题目】有一袋已部分变质的 Ca(OH)2(含杂质 CaCO3)固体样品,把该样品投入足量水中,充分搅拌后通入二氧化碳,沉淀质量与反应的二氧化碳质量关系如图所示。
(提示:CO2+Ca(OH)2=CaCO3↓+H2O CO2+CaCO3+H2O=Ca(HCO3)2)请回答下列问题:
(1)Ca(OH)2 由_____元素组成,其中 H 元素与 O 元素的原子个数比为_____ ;
(2)碳酸钙(CaCO3)的相对分子质量为_____;
(3)生成沉淀最多时,参加反应的气体质量为_____ g;
(4)计算样品中碳酸钙的质量分数_____。(要求写出计算过程,结果精确到 0.1%)

【答案】三种或者钙、氧、氢;1:1;100;4.4;40.3%。
【解析】
(1)根据Ca(OH)2,可知氢氧化钙是由钙、氧、氢三种元素组成,所以此处可以填写具体元素也可以填三种,其中H元素与O元素的原子个数比为 1:1;(2)碳酸钙(CaCO3)的相对分子质量为40+12+16×3=100;(3)由图可以看出生成沉淀最多时,参加反应的气体质量为 4.4g;(4)沉淀增加过程只消耗了4.4g,这个过程是二氧化碳和氢氧化钙反应的,所以可以确定氢氧化钙的质量:CO2+Ca(OH)2=CaCO3↓+H2O、CO2+CaCO3+H2O=Ca(HCO3)2,可知:氢氧化钙转化为碳酸钙和该碳酸钙转化为碳酸氢钙需要的二氧化碳质量相等,所以氢氧化钙转化为碳酸钙需要的二氧化碳为4.4g,则该碳酸钙转化为碳酸氢钙需要的二氧化碳也是4.4g,则单纯和原混合物中碳酸钙反应的二氧化碳只有11g-4.4g-4.4g=2.2g,设原混合物中氢氧化钙的质量为x,碳酸钙的质量为y,
CO2+ Ca(OH)2=CaCO3↓+H2O
4474
4.4gx
![]()
x=7.4g,
CO2+CaCO3+H2O=Ca(HCO3)2
44 100
2.2g y
![]()
y=5g,
样品中碳酸钙的质量分数为![]() ×100%≈40.3%。
×100%≈40.3%。

【题目】水是人及一切生物生存所必需的,尽管地球上的总水量很大,但是淡水资源却很不充裕,其中可用的淡水量就更少,还不到总水量的1%.
(1)根据下面两张图表提供的有关数据,北京水资源紧缺指标属于________范围.所以,我们每个北京市民都必须爱护水资源,一方面要防止水体污染,另一方面要________用水.
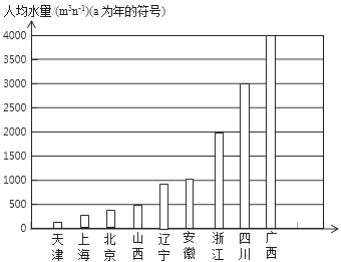
紧缺程度 | 轻度缺水 | 中度缺水 | 重度缺水 | 极度缺水 |
人均水量 (其中a为年) | 1700~3000 | 1000~1700 | 500~1000 | <500 |
(2)请写出如图所示徽记的名称,再简述它的涵义是什么? ________
________
(3)关心水、爱惜水、保护水是每个公民应尽的义务.请你提出三条家庭节约用水的措施.________