题目内容
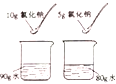
【题目】现有一包由 5.6g 铁、7.2g 镁、1.4g 碳混合而成的粉末,把它加入一 定量的 Cu(NO3)2 溶液中。实验结束后,测得剩余固体中含有三种物质。则剩 余固体的质量可能是( )
A. 24.8g B. 25.8g C. 26.8g D. 27.8g
【答案】C
【解析】
解:因为镁最活泼,所以最先反应,只有镁完全反应后铁才能才加反应,而碳不参与反应,设镁完全反应生成的铜的质量为x,
Mg+Cu(NO3)2=Mg(NO3)2+Cu
24 64
7.2g x
![]()
x=19.2g,
设铁完全反应生成的铜的质量为y,
Fe+Cu(NO3)2=Fe(NO3)2+Cu
5664
5.6gy
![]()
y=6.4g,由于剩余固体中含有三种物质,所以可能是镁完全反应,则对应的固体的质量为19.2g+5.6g+1.4g=26.2g,也可能铁部分反应,若铁完全反应则对应固体的质量为19.2g+6.4g+1.4g=27g,由于剩余三种固体,所以铁不能完全反应,则固体质量不能大于27g,所以固体的质量应该是大于26.2g而小于27g,则应该选C。故选C。

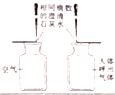
【题目】元素周期表是学习和研究化学的重要工具,请按表中信息填空:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10___________ 氖20.18 |
3 | 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)写出原子序数为10的元素符号___________,其相对原子质量是___________.
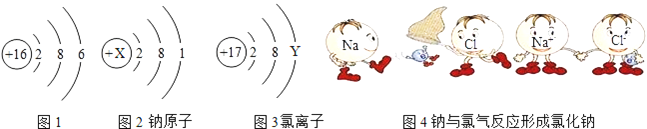
(2)硫元素的原子结构示意图如图1所示,该元素的原子核外有___________个电子层,它属于___________元素(填“金属”、“非金属”).
(3)根据如图2、图3、图4所示信息回答.
①图2中X为___________,图3中Y为___________.
②与氯离子具有相同核外电子排布的原子的元素符号为___________.
③已知:金属钠可在氯气(Cl2)中燃烧生成氯化钠,写出该反应的化学方程式.___________.