题目内容
【题目】某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。

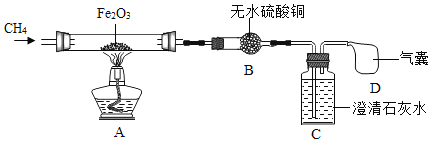
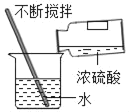
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用如图所示装置制取NaHCO3,得到的另一种产品NH4Cl,然后再将NaHCO3制成Na2CO3。
(1)写出仪器a的名称_____,装置丙中反应的化学方程式为_____。
(2)装置乙的作用是___________。为防止污染空气,尾气中的__________需要进行吸收处理。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有___________、___________、___________。
Ⅱ.测定所得产品的组成
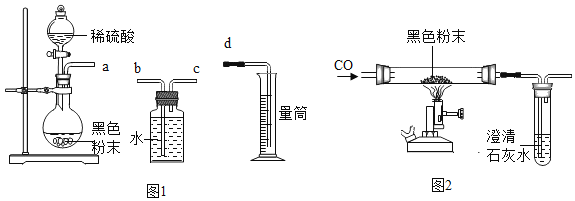
(4)检验纯碱样品中是否混有NaHCO3,请选择如图装置设计实验,并完成下表:
选择的装置(填编号) | 实验现象 | 实验结论 |
_____ | _____ | 样品中含NaHCO3 |
【答案】烧瓶 NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl 除去二氧化碳中的氯化氢 氨气 过滤 洗涤 灼烧 A、B B溶液变浑浊
【解析】
(1)由所学知识可知,仪器a的名称为烧瓶,装置丙中反应的化学方程式为NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl;
(2)盐酸易挥发出来氯化氢气体,氯化氢和碳酸氢钠反应生成氯化钠、二氧化碳、水,装置乙的作用是除去二氧化碳中的氯化氢。氨气是有毒气体,为防止污染空气,尾气中的氨气需要进行吸收处理。
(3)常温下碳酸氢钠的溶解度较小,绝大部分以晶体形式存在,碳酸氢钠在加热条件下分解生成碳酸钠、二氧化碳、水,用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有过滤、洗涤、加热;
(4)酸氢钠在加热条件下分解生成碳酸钠、二氧化碳、水,碳酸钠在加热条件下不分解,检验纯碱样品中是否混有NaHCO3,应选择发生装置A,然后用装置B检验生成的气体为二氧化碳,即澄清石灰水变浑浊证明有碳酸氢钠。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案