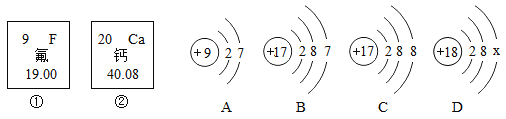
题目内容
【题目】某兴趣小组对工业炼铁的相关知识进行了深入研究。
(知识回顾)工业炼铁的主要原料是铁矿石、焦炭、石灰石和空气,下列相关知识的归纳,正确的是_____。
A 工业炼铁得到的是纯铁
B CO还原氧化铁的反应属于置换反应
C 焦炭燃烧放热,提高炉温,并转化成CO
D 炼铁高炉排放的废气对空气无污染
(提出问题)该小组同学发现甲烷的性质与氢气、一氧化碳有很多相似之处。氢气、一氧化碳具有还原性,那么甲烷有没有还原性呢?
(查阅资料)1 无水硫酸铜是白色固体,吸收水分后变为蓝色。
2 铁的氧化物与稀硫酸反应时无气体生成
(实验探究)为探究上述问题,设计如下装置并进行实验。

(1)实验开始时先通一段时间甲烷的目的是_____________________。
(2)加热一段时间后,观察到A中硬质玻璃管中的固体粉末由红色全部变成黑色,取少量黑色粉末于试管中,加入适量稀盐酸,观察到________(填实验现象),说明有铁生成;B中白色固体变蓝,说明有_____生成;C中澄清石灰水变浑浊,说明有二氧化碳生成。
(结论)甲烷有还原性。若生成的黑色粉末全部是铁,甲烷还原氧化铁的化学方程式为__________________________。
(反思质疑)查阅资料得知:酒精灯加热时达不到高温,生成物中可能混有铁的其他氧化物FexOy.为探究甲烷与氧化铁反应后所得黑色粉末的成分,继续进行如下实验:
(1)探究黑色粉末中单质铁的质量分数:
①将如图各装置按照一定顺序连接,接口顺序是a→_____→_____→d(填序号)。

②检查装置气密性,称取7.2g黑色粉末 放入烧瓶中,向分液漏斗中加入稀硫酸。打开分液漏斗活塞,逐滴加入稀硫酸至无气泡产生,通过测量量筒内水的体积得出氢气质量为0.05g。计算黑色粉末中单质铁的质量分数。_______________(写出计算过程,结果保留到0.1%)
(2)确定黑色粉末中FexOy的化学式:
检查如图装置的气密性,另称取上述黑色粉末7.2g放入硬质玻璃管中,加热至完全反应,称得硬质玻璃管内剩余固体为5.6g,经检验全都是铁。若原黑色粉末中铁的氧化物只有一种,则FexOy的化学式为_____。从环保角度分析,如图装置存在的明显缺陷是_____________________________。
【答案】C 排尽装置内的空气,防止加热时产生爆炸 有气泡产生 水 4Fe2O3+3CH4![]() 8Fe+6H2O+3CO2 c b 19.4% FeO 未进行尾气处理
8Fe+6H2O+3CO2 c b 19.4% FeO 未进行尾气处理
【解析】
[知识回顾]
A 工业炼铁得到的是含有碳等杂质的生铁,不是纯铁;
B 一种单质和一种化合物生成另一种单质和一种化合物的反应叫置换反应,CO还原氧化铁的反应两种反应物都是化合物,不属于置换反应;
C 焦炭燃烧生成二氧化碳时放出大量热,提高炉温,二氧化碳和碳在高温下反应生成CO;
D 炼铁高炉排放的废气中有一氧化碳,对空气有污染;故选C;
[实验探究](1)点燃或加热有空气的混合物易发生爆炸,实验开始时先通一段时间甲烷的目的是排尽装置内的空气,防止加热时产生爆炸;
(2)加热一段时间后,观察到A中硬质玻璃管中的固体粉末由红色全部变成黑色,取少量黑色粉末于试管中,加入适量稀盐酸,观察到有气泡产生,溶液由无色变成浅绿色,说明有铁生成;B中白色固体变蓝,说明有水生成;C中澄清石灰水变浑浊,说明有二氧化碳生成;
[结论]甲烷有还原性。若生成的黑色粉末全部是铁,甲烷还原氧化铁的化学方程式为4Fe2O3+3CH4![]() 8Fe+6H2O+3CO2;
8Fe+6H2O+3CO2;
[反思质疑](1)探究黑色粉末中单质铁的质量分数:
①将如图各装置按照一定顺序连接,生成气体进入集气瓶,在压力的作用下水进入量筒,进入量筒的水的体积等于进入集气瓶氢气的体积,接口顺序是a→c→b→d;
②检查装置气密性,称取7.2g黑色粉末 放入烧瓶中,向分液漏斗中加入稀硫酸。打开分液漏斗活塞,逐滴加入稀硫酸至无气泡产生,通过测量量筒内水的体积得出氢气质量为0.05g。设黑色粉末中单质铁的质量为x,
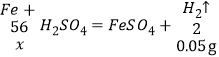
![]() x=1.4g
x=1.4g
黑色粉末中单质铁的质量分数:
![]() ;
;
(2)检查如图装置的气密性,另称取上述黑色粉末7.2g放入硬质玻璃管中,加热至完全反应,称得硬质玻璃管内剩余固体为5.6g,经检验全都是铁,则氧元素的质量为:7.2g-
5.6g=1.6g,若原黑色粉末中铁的氧化物只有一种,则FexOy,铁与氧元素的原子个数比为:![]() ,化学式为FeO。从环保角度分析,如图装置存在的明显缺陷是没有尾气处理装置,易导致污染空气。
,化学式为FeO。从环保角度分析,如图装置存在的明显缺陷是没有尾气处理装置,易导致污染空气。

【题目】某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
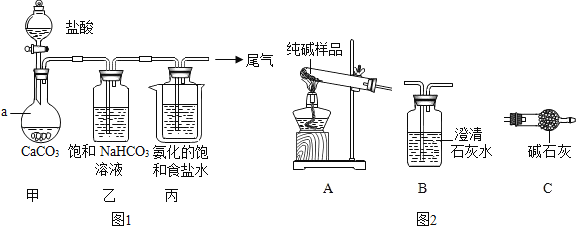
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用如图所示装置制取NaHCO3,得到的另一种产品NH4Cl,然后再将NaHCO3制成Na2CO3。
(1)写出仪器a的名称_____,装置丙中反应的化学方程式为_____。
(2)装置乙的作用是___________。为防止污染空气,尾气中的__________需要进行吸收处理。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有___________、___________、___________。
Ⅱ.测定所得产品的组成
(4)检验纯碱样品中是否混有NaHCO3,请选择如图装置设计实验,并完成下表:
选择的装置(填编号) | 实验现象 | 实验结论 |
_____ | _____ | 样品中含NaHCO3 |
【题目】暖宝宝是一种防寒用品,暖宝宝的成分和发热的原理是什么?小明将如图的暖宝宝剪开内包装袋,倒出其中的粉末,发现粉末呈黑色。他在查阅资料后推测黑色粉末可能含有木炭粉、铁粉、氧化铜中的两种物质组成。

(猜想)黑色粉末是:猜想①铁粉和木炭粉;猜想②木炭粉和氧化铜;猜想③_____;
(查阅资料)(1)木炭与稀硫酸不反应,氧化铜与稀硫酸反应能产生蓝色溶液。
(2)暖宝宝中除了黑色粉末外,还含有氯化钠(俗名食盐)和水。
(进行实验)
实验操作步骤 | 实验现象 | 结论 |
①取少量黑色粉末于试管中,加足量稀硫酸 | 固体部分溶解,有气泡产生,溶液未变蓝色 | 黑色粉末中:一定含有_;一定不含__。 |
②取实验①的残渣灼烧,将内壁涂有澄清石灰水的小烧杯罩在上方 | ___ | 该黑色粉末中一定含有木炭粉。 |
(实验结论)猜想①正确。
(反思评价)(1)写出实验①的化学反应方程式:_____。
(2)宝宝贴在衣服上与空气接触后会发热的原因是_____。
(3)结合生活中常见现象,请你猜测暖宝宝中氯化钠的作用是_____。